题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 粗铜精炼中,外电路转移电子数为NA时,阳极质量减小32g
B. 5.6gFe与足量的硫充分反应,转移电子数为0.3NA
C. 室温下,醋酸铵的水溶液呈中性,溶液中所含H+数目为10-7NA
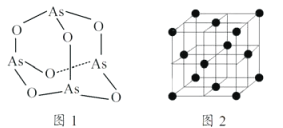
D. S8分子结构如图,1mol该分子中含有S—S键个数为8NA
【答案】D
【解析】
A.粗铜精炼时,阳极溶解的金属有Cu,还有各种活动性不同的金属,所以外电路转移电子数为NA时,阳极质量不一定是32g,A错误;
B.Fe与S在加热时发生反应产生FeS,每1molFe反应转移2mol电子,5.6gFe物质的量是0.1mol,所以5.6gFe与足量的硫充分反应,转移电子数为0.2NA,B错误;
C.缺少溶液的体积,不能计算微粒数目,C错误;
D.根据S8结构示意图可知:每个分子中含8个S—S键,则1mol该分子中含有S—S键个数为8NA,D正确;
故合理选项是D。

【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
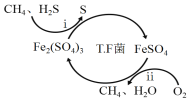
(1)过程i的离子反应方程式为_________________________________________。
(2)已知:
①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:_______________________________________________。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
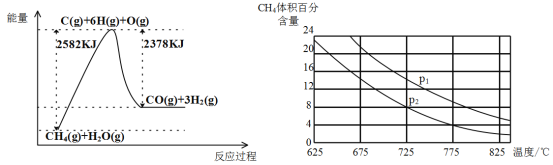
(3)①该过程的热化学方程式是__________________________________________。
②比较压强P1和p2的大小关系:P1 _________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
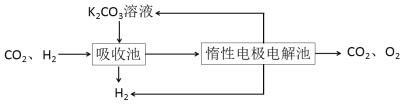
(4)吸收池中发生反应的离子方程式是____________________________________。