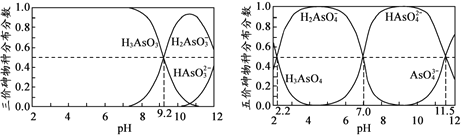
题目内容
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
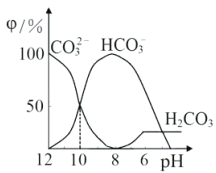
A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
【答案】A
【解析】
A、由电荷守恒可知,c(Na+)+c(H+)=(OH- )+Cl- )+c(HCO3-)+2c(CO32-), pH=7时,c(H+)=(OH- ),则c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-),故A正确;
B、据图可知,pH=8时溶液中溶质为碳酸氢钠和氯化钠,则溶液中c(Cl-)<c(Na+),故B错误;
C、pH=12时,溶液为Na2CO3溶液,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,碳酸氢根离子水解生成碳酸和氢氧根离子, 则c(Na+ )>c(CO32-)>c(OH- )>c(HCO3-)>c(H+),故C错误;
D、CO32-的水解常数Kh=c(HCO3-)c(OH-)/c(CO32-),据图可知,当溶液中c(HCO3-):c(CO32-)=1:1时,溶液的pH=10,c(H+)=10-10mol·L-1,由Kw可知c(OH-)=10-4mol·L-1,则Kh=c(HCO3-)c(OH-)/c(CO32-)=c(OH-)=10-4mol·L-1,故D错误;
故选A。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)③、④、⑤、⑥简单离子半径由小到大的顺序为_____________________。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

(a)X溶液与Y溶液反应的离子方程式为_________,
(b)N→⑥的单质的化学方程式为________________。