题目内容
用质量均为100g的铜作电极,电解硝酸银溶液(足量),电解一段时间后,两电极的质量差为28g,此时两电极的质量分别为( )
| A.阳极100g,阴极128g | B.阳极93.6g,阴极121.6g |
| C.阳极91.0g,阴极119.0g | D.阳极86.0g,阴极114.0g |
B
解析试题分析:根据题意知,用铜作电极电解硝酸银溶液时,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu 2+,阴极上银离子得电子生成银,电极反应式为Ag++e-=Ag,设阴极析出银的质量为x,阳极溶解铜的质量为y,根据电子守恒得x/108=2y/64,两个电极质量差为溶解铜的质量和析出银的质量之和,所以x+y=28,解得x=21.6,y=6.4。所以阳极上金属质量=100g-6.4g=93.6g,阴极上金属质量=100g+21.6g=121.6g,选B。
考点:考查电解原理的应用、电解计算。

 阅读快车系列答案
阅读快车系列答案把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲的质量减少;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
| A.甲>乙>丙>丁 | B.甲>丙>乙>丁 |
| C.甲>丙>丁>乙 | D.乙>丁>丙>甲 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。下列说法不正确的是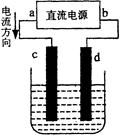
| A.a为正极、b为负极 |
| B.c为阳极、d为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确是
| A.阳极反应为Fe-2e- =Fe2+ |
| B.电解过程中溶液pH不会变化 |
| C.过程中有Fe(OH)3沉淀生成 |
| D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
某研究性学习小组进行电化学实验,研究装置如图所示。
有关说法不正确的是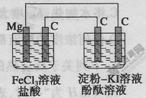
| A.镁为负极 |
| B.原电池中碳极的电极反应式为Fe3++e-=Fe2+ |
| C.电解池中阳极处先变红 |
| D.电解池中阴极的电极反应式为2H++2e-=H2↑ |
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li + I2 →2LiI。下列有关说法错误的是
| A.放电时化学能转化为电能 | B.负极反应为:Li –e→Li+ |
| C.正极反应为:I2+2e →2I- | D.电子由正极流向负极 |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成下图所示的原电池。下列判断不正确的是

A.为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液 |
B.反应开始时,甲中石墨电极上Fe3+被还原,乙中石墨电极上发生氧化反应 |
C.电流计读数为零时,在甲中加入FeCl2固体后,甲中石墨电极为负极 |
| D.此反应正反应方向若为放热反应,电流计读数为零时,降低温度后,乙中石墨电极为负极 |
用惰性电极电解一定量的硫酸铜溶液,实验装置如图1所示。电解过程中的实验数据如图2所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标况)。则下列说法中正确的是

| A.电解过程中,b电极表面先有红色物质析出,然后才有气泡产生 |
| B.从开始到Q点时收集到的混合气体的平均相对分子质量为17 |
| C.曲线OP 段表示H2和O2混合气体的体积变化,曲线PQ段表示O2的体积变化 |
| D.a电极上发生反应的方程式为:2H+ + 2e- = H2↑和4OH-–4 e-=2H2O+ O2↑ |
 导线
导线