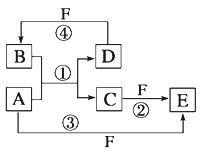
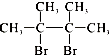题目内容
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下:CH3CH2OH ![]() CH2=CH2 , CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图:
CH2=CH2 , CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图: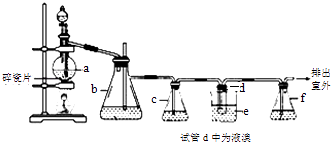
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
回答下列问题:
(1)在装置c中应加入(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是 .
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的(填“上”或“下”)层.
(4)若产物中有少量未反应的Br2 , 最好用(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是;但不用冰水进行过度冷却,原因是:
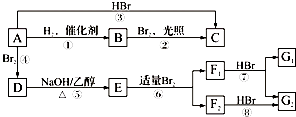
(6)以1,2﹣二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2﹣二溴乙烷通过(①)反应制得(②),②通过( ③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①(填反应类型)②(填该物质的电子式)③(填反应类型)写出第一步的化学方程式 .
【答案】
(1)③
(2)溴的颜色完全褪去
(3)下
(4)②
(5)乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2﹣二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞
(6)消去反应;![]() ;加成反应;
;加成反应;![]() .
.
【解析】解:实验室制备1,2﹣二溴乙烷的反应原理为:乙醇发生消去反应生成乙烯:CH3CH2OH ![]() CH2=CH2 , 然后乙烯与溴发生加成反应生成1,2﹣二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br;产物中混有的溴单质可以用氢氧化钠溶液除去,(1)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,所以③正确,所以答案是:③;(2)乙烯和溴水发生加成反应生成1,2﹣二溴乙烷,1,2﹣二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,所以答案是:溴的颜色完全褪去;(3)1,2﹣二溴乙烷和水不互溶,1,2﹣二溴乙烷密度比水大,有机层在下层,所以答案是:下;(4)①溴更易溶液1,2﹣二溴乙烷,用水无法除去溴,故①错误;②常温下Br2和氢氧化钠发生反应2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,故②正确;③NaI与溴反应生成碘,碘与1,2﹣二溴乙烷互溶,不能分离,故④③错误;④酒精与1,2﹣二溴乙烷互溶,不能除去混有的溴,故④错误;所以答案是:②;(5)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2﹣二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,B中长导管内液面上升,所以答案是:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2﹣二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞;(6)以1,2﹣二溴乙烷为原料,制备聚氯乙烯,可以先用1,2﹣二溴乙烷通过消去反应反应制得乙炔,然后通过乙炔与氯化氢的加成反应制得氯乙烯,最后由氯乙烯通过加聚反应制得聚氯乙烯,反应①为1,2﹣二溴乙烷通过消去反应反应制得乙炔,②乙炔为共价化合物,分子中含有碳碳三键,乙炔的电子式为:
CH2=CH2 , 然后乙烯与溴发生加成反应生成1,2﹣二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br;产物中混有的溴单质可以用氢氧化钠溶液除去,(1)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,所以③正确,所以答案是:③;(2)乙烯和溴水发生加成反应生成1,2﹣二溴乙烷,1,2﹣二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,所以答案是:溴的颜色完全褪去;(3)1,2﹣二溴乙烷和水不互溶,1,2﹣二溴乙烷密度比水大,有机层在下层,所以答案是:下;(4)①溴更易溶液1,2﹣二溴乙烷,用水无法除去溴,故①错误;②常温下Br2和氢氧化钠发生反应2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,故②正确;③NaI与溴反应生成碘,碘与1,2﹣二溴乙烷互溶,不能分离,故④③错误;④酒精与1,2﹣二溴乙烷互溶,不能除去混有的溴,故④错误;所以答案是:②;(5)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2﹣二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,B中长导管内液面上升,所以答案是:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2﹣二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞;(6)以1,2﹣二溴乙烷为原料,制备聚氯乙烯,可以先用1,2﹣二溴乙烷通过消去反应反应制得乙炔,然后通过乙炔与氯化氢的加成反应制得氯乙烯,最后由氯乙烯通过加聚反应制得聚氯乙烯,反应①为1,2﹣二溴乙烷通过消去反应反应制得乙炔,②乙炔为共价化合物,分子中含有碳碳三键,乙炔的电子式为: ![]() ;③为乙炔与氯化氢的加成反应制得氯乙烯;第一步反应为1,2﹣二溴乙烷通过消去反应反应制得乙炔,反应方程式为:
;③为乙炔与氯化氢的加成反应制得氯乙烯;第一步反应为1,2﹣二溴乙烷通过消去反应反应制得乙炔,反应方程式为: ![]() ,所以答案是:消去反应;
,所以答案是:消去反应; ![]() ;加成反应;
;加成反应; ![]() .
.

 阅读快车系列答案
阅读快车系列答案【题目】人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H= .
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: .
(2)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
(3)利用钠碱循环法可除去SO2 , 消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显性.
②在NaHSO3溶液中离子浓度关系正确的是 (填字母).
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
c.c(H2SO3)+c(H+)=c(SO32﹣)+(OH﹣)
d.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)