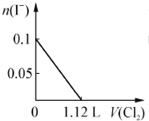
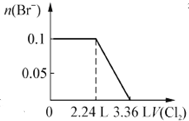
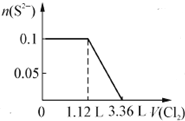
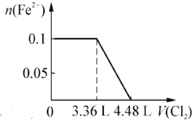
题目内容
4.下列表示对应化学反应的离子方程式正确的是( )| A. | 碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | 将过量二氧化硫气体入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ |
分析 A.氢氧化钙完全反应,生成碳酸钡、碳酸钠、水;
B.漏写碳酸氢根离子与碱的反应;
C.反应生成亚硫酸氢铵;
D.醋酸在离子反应中保留化学式.
解答 解:A.碳酸氢钠溶液中滴入氢氧化钙溶液的离子反应为Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故A错误;
B.向NH4HCO3溶液中加过量NaOH溶液并加热的离子反应为NH4++HCO3-+2OH-═CO32-+NH3.H2O+H2O,故B错误;
C.将过量二氧化硫气体入冷氨水中的离子反应为SO2+NH3•H2O═HSO3-+NH4+,故C正确;
D.硅酸钠溶液与醋酸溶液混合的离子反应为SiO32-+2CH3COOH═H2SiO3↓+2CH3COO-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ.为确认该溶液组成进行如下实验:①取20.0mL该溶液,加入25.0mL 4.00mol•L-1NaOH溶液,有白色沉淀、无剌激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20mol•L-1;②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.由此可得出关于原溶液组成的正确结论是( )
| A. | 一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ | |
| B. | 一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ | |
| C. | c(Clˉ)为 4.00mol•L-1,c(Al3+)为1.00 mol•L-1 | |
| D. | c(Mg2+)为 1.00mol•L-1,c(Na+)为 0.50 mol•L-1 |
9.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 若将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| B. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后 |
16.LiAlH4、LiH是金属储氢材料,遇水均能剧烈反应放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法错误的是( )
| A. | LiH与D2O反应,所得氢气的摩尔质量为4g/mol | |
| B. | 1mol LiAlH4在125℃完全分解,转移3mol电子 | |
| C. | LiH与水反应的化学方程式为:LiH+H2O=LiOH+H2↑ | |
| D. | LiH与中微粒半径r(Li+)>r(H-) |
9.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,48gO2和O3含有的氧原子数均为3NA5.4g铝与足量NaOH反应转移的电子数为0.3NA | |
| B. | 12g重水(D2O)中含有的电子数为6 NA | |
| C. | 标准状况下,11.2L苯所含原子数为6NA | |
| D. | 160g胆矾溶于水形成1L溶液,溶液的物质的量浓度为1mol/L |
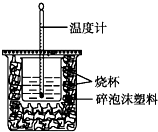 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: