题目内容
12. 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:(1)基态铜原子的电子排布式为1s22s22p63s23p63d104s1;已知高温下CuO-→Cu20+02,试从铜原子价层电子结构变化角度解释这一反应发生的原因:Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,3d10为稳定结构,所以在高温时,Cu2+得一个电子变成稳定结构的Cu+.
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为V形,正四面体,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se>Si.
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为sp3,B与N之间形成配位键.
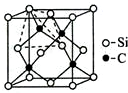
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为原子晶体,在SiC中,每个C原子周围最近的C原子数目为12,若晶胞的边长为a pm,则金刚砂的密度为$\frac{1.6×1{0}^{32}}{{N}_{A}}a$g•cm3.
分析 (1)根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;Cu+的核外有28个电子,根据构造原理书写其基态离子核外电子排布式,原子轨道处于全空、半满或全满时最稳定;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别与H2O,CH4相似;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价;
(3)根据价层电子对互斥理论确定其杂化方式,提供空轨道的原子和提供孤电子对的原子之间形成配位键;
(4)根据原子晶体的硬度大;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,据此判断每个C原子周围最近的C原子数目;该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,根据ρ=$\frac{m}{V}$计算其密度.
解答 解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1;Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,3d10为稳定结构,所以在高温时,Cu2+得一个电子变成稳定结构的Cu+;
故答案为:1s22s22p63s23p63d104s1;Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,3d10为稳定结构,所以在高温时,Cu2+得一个电子变成稳定结构的Cu+;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别V形,正四面体;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si;
故答案为:V形,正四面体;Se>Si;
(3)BF3•NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键;
故答案为:sp3;配位;
(4)金刚砂(SiC)的硬度为9.5,属于原子晶体;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个C原子周围最近的C原子数目为3×4=12;该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,ρ=$\frac{m}{V}$=$\frac{\frac{40×4}{{N}_{A}}}{(a×1{0}^{-10})^{3}}$g•cm3=$\frac{1.6×1{0}^{32}}{{N}_{A}}a$g•cm3;
故答案为:原子晶体;12;$\frac{1.6×1{0}^{32}}{{N}_{A}}a$g•cm3.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化判断、原子核外电子排布式的书写等知识点,难点是晶胞计算,题目难度中等.

| A. | n(KOH)=n(KHCO3) | B. | n(KOH)<n(KHCO3) | C. | n(KOH)>n(KHCO3) | D. | KOH、KHCO3任意比 |
| A. | 锌为正,空气进入负极反应 | B. | 负极反应为Zn+2OH--2e-═ZnO+H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液可以是强酸也可以是强碱 |
Ⅰ.配制0.50mol•L-1 NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如下表.
①请填写表中的空白:已知:反应后混合溶液的比热容c=4.2×10-3 kJ/(g•℃)
| 温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0℃ |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
③能引起中和热偏高的原因是B
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2FeCl2+Cl2═2FeCl3 | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | Cl2+H2O═HClO+HCl |