题目内容
【题目】将如图所示实验装置的K闭合,下列判断正确的是( )
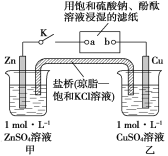
A.电子沿Zn→a→b→Cu路径流动
B.Cu电极上发生还原反应
C.片刻后甲池中c(SO![]() )增大
)增大
D.片刻后可观察到滤纸b点变红色
【答案】B
【解析】
试题分析:A、闭合K构成原电池,锌比铜活泼,锌作负极,铜作正极,根据原电池工作原理,电子从Zn流出,达到a,在滤纸上没有电子的通过,只有阴阳离子的定向移动,电子从b流向Cu,故错误;B、根据选项A的分析,Cu作正极,根据原电池的工作原理,正极上发生还原反应,故正确;C、盐桥的作用是形成闭合回路,平衡两烧杯的电荷守恒,因此Cl-流向甲池,溶液中c(SO42-)不变,故错误;D、滤纸相当于电解池,b接电源的正极,b作阳极,发生电极反应式为4OH-4e-=2H2O+O2↑,a接电源的负极,作阴极,电极反应式为2H2O-2e-=H2↑+2OH-,因此a极变红,故错误。

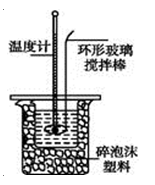
【题目】用100mL 1.00mol·L-1盐酸与100mL 1.10mol·L-1NaOH溶液在如下图所示的装置中进行中和热测定实验。以下是四次实验所得数据。回答下列问题:
实验 数据 | 盐酸起始温度t1/℃ | 氢氧化钠起始温度t2/℃ | 两溶液混合后 温度t3/℃ |
1 | 21.0 | 21.1 | 26.9 |
2 | 21.5 | 21.7 | 28.2 |
3 | 21.9 | 22.1 | 28.7 |
4 | 22.3 | 22.5 | 29.2 |
(1)上表中的温度差平均值为 ℃
(2)近似认为上述两种溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则计算得到中和热ΔH= (取小数点后一位)。
(3)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用环形铜质搅拌棒代替环形玻璃搅拌棒
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸溶液起始温度后直接测定NaOH溶液的温度