题目内容
【题目】在一密闭容器中,反应aA(气)![]() bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增加了 D. a>b
【答案】C
【解析】假定平衡不移动,将气体体积增大到原来的一倍,B的浓度为原来的50%,实际再次达到新平衡时,B的浓度为原来的70%,说明压强减小,平衡向正反应移动,即a<b,A的转化率增大,则
A.由上述分析可知,平衡向正反应方向移动,故A不正确;
B.平衡向正反应方向移动,物质A的转化率增大,故B不正确;
C.B的浓度为原来的70%,说明压强减小,平衡向正反应移动,物质B的质量分数增加了,故C正确;
D.B的浓度为原来的70%,说明压强减小,平衡向正反应移动,正向体积增大,即a<b,故D不正确.
故选C.

【题目】用100mL 1.00mol·L-1盐酸与100mL 1.10mol·L-1NaOH溶液在如下图所示的装置中进行中和热测定实验。以下是四次实验所得数据。回答下列问题:
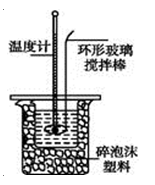
实验 数据 | 盐酸起始温度t1/℃ | 氢氧化钠起始温度t2/℃ | 两溶液混合后 温度t3/℃ |
1 | 21.0 | 21.1 | 26.9 |
2 | 21.5 | 21.7 | 28.2 |
3 | 21.9 | 22.1 | 28.7 |
4 | 22.3 | 22.5 | 29.2 |
(1)上表中的温度差平均值为 ℃
(2)近似认为上述两种溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则计算得到中和热ΔH= (取小数点后一位)。
(3)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用环形铜质搅拌棒代替环形玻璃搅拌棒
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸溶液起始温度后直接测定NaOH溶液的温度