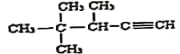题目内容
【题目】废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
I.若碱性锌锰干电池的总反应为:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2 ,则该电池的正极反应式为:_________________________________
II.回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
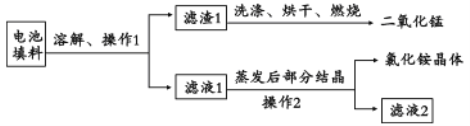
(1)① 操作中先将电池填料研碎的目的是:________________。操作l和操作2的名称都是___________,② 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
(3)部分难溶的电解质溶度积常数(Ksp)如下表:

用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
【答案】2MnO2+2H2O+2e-=2MnO(OH)+2OH- 增大接触面积,加快反应速率 过滤 除去二氧化锰中混有的碳粉 2MnOOH+6HCl(浓)= 2MnCl2+ Cl2↑+4 H2O 工艺流程简单;反应过程无有毒有害物质生成,不会造成二次污染;废物资源化;生成的产物CO2和H2O不会影响MnSO4的纯度 2.6×10-9 mol·L-1 6
【解析】
I.该原电池中正极上二氧化锰得电子发生还原反应;
II.废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水,溶解过滤后得到滤渣1为二氧化锰、碳粉,滤液为氯化铵和氯化锌,滤渣1洗涤烘干、灼烧除去碳得到二氧化锰,滤液1蒸发结晶过滤得到氯化铵晶体和滤液2;
(1)从化学反应速率的因素分析;过滤可以除去不溶于水的物质;玻璃棒的用途有搅拌、引流、转移物质等;加热条件下,炭粉能和空气中的氧气反应生成二氧化碳;
(2)①MnO(OH)与浓盐酸反应,+3价的锰能把浓盐酸氧化为氯气;
②分析回收工艺的优点从可操作性、产品的纯度、对环境的影响等方面分析;
(3)根据Ksp计算公式进行求解;
I.锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O═2MnO(OH)+Zn(OH)2,该原电池中正极上二氧化锰得电子发生还原反应,故答案为:2MnO2+2H2O+2e-═2MnO(OH)+2OH-;
II.(1)①将电池填料研碎的目的是增大接触面积,加快反应速率,操作1和操作2的名称都是过滤。故答案为:增大接触面积,加快反应速率;过滤;
②灼烧滤渣l的目的是使炭粉和氧气反应转化成二氧化碳,从而和二氧化锰分离。故答案为:除去二氧化锰中混有的碳粉;
(2)①+3价的锰能把浓盐酸氧化为氯气,即MnO(OH)与浓盐酸反应生成氯气和氯化锰、水, 故答案为:![]() ;
;
②从可操作性、产品的纯度、对环境的影响等方面分析回收工艺的优点可知答案为:工艺流程简单;生成CO2和H2O不影响MnSO4纯度;反应过程无有毒有害物质生成,不造成二次污染;废物资源化等;
(3)加碱调节pH为4,溶液中c(OH-)=10-10mol/L,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=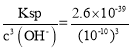 =2.6×10-9mol/L,如锌开始沉淀,则c(OH-)=
=2.6×10-9mol/L,如锌开始沉淀,则c(OH-)=![]() =10-8mol/L,此时pH=6,故答案为:2.6×10-9mol/L;6.
=10-8mol/L,此时pH=6,故答案为:2.6×10-9mol/L;6.