题目内容
【题目】在2L的恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下列有关说法正确的是
2SO3(g),下列有关说法正确的是
A.由图①可知:该反应的△H>0
B.在图②中的t1时充入少量氩气,容器内压强增大,平衡右移
C.图③所示条件下,平衡常数为2
D.图④中的y可以表示平衡常数或密度
【答案】D
【解析】
A.图象分析可知温度为T2前三氧化硫含量增大,T2温度后三氧化硫含量减小,说明T2前反应未达到平衡状态,T2是达到平衡状态,温度升高平衡逆向进行,逆反应为吸热反应,正反应为放热反应,△H<0,故A错误;
B.恒容容器中充入少量氩气,容器内压强增大但分压不变,平衡不发生移动,故B错误;
C.平衡时二氧化硫转化率50%,结合化学反应三行计算平衡浓度,

平衡常数![]() ,故C错误;
,故C错误;
D.反应平衡常数随温度变化,温度不变平衡常数不变,反应前后气体质量和体积不变,密度始终不变,图象变化符合,故D正确;
故选D。

 轻松夺冠全能掌控卷系列答案
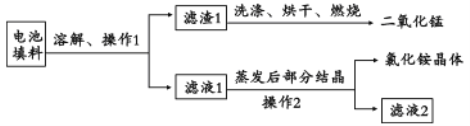
轻松夺冠全能掌控卷系列答案【题目】2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品。
(1)NaCN溶液中各离子浓度大小关系为 ______ 。已知NaCN遇酸能产生HCN;![]() 时,HCN的电离常数
时,HCN的电离常数![]()
![]() ;
;![]() 的电离常数
的电离常数![]()
![]() 。体积均为100mL、
。体积均为100mL、![]() 的
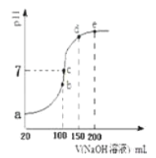
的![]() 溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示
溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示![]() 溶的pH变化趋势的曲线是 ______
溶的pH变化趋势的曲线是 ______ ![]() 选填“A”或“B”
选填“A”或“B”![]() ;相同条件下,NaCN溶液的pH ______
;相同条件下,NaCN溶液的pH ______ ![]() 选填“
选填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 溶液的pH。
溶液的pH。
(2)200℃固体硝酸铵可以分解为![]() 和
和![]() ,此过程中每转移电子8mol放出热量
,此过程中每转移电子8mol放出热量![]() ,写出此反应的热化学方程式 ______ 。
,写出此反应的热化学方程式 ______ 。
(3)工业上用氯气和二氧化钛制备![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ;
;![]() 。此温度下,该反应的平衡常数为400,在密闭容器中加入
。此温度下,该反应的平衡常数为400,在密闭容器中加入![]() 和
和![]() ,反应到t时刻测得各组分的浓度如表所示:
,反应到t时刻测得各组分的浓度如表所示:
物质 |
|
|
|
浓度 |
|
|
|
①根据表中数据判断t时刻此反应向 ______ 反应方向进行![]() 选填“正”或“逆”
选填“正”或“逆”![]() 。
。
②若经10min反应达到平衡,则该时间内反应速率![]() ______。
______。![]() ;下列措施中,可以使平衡向右移动的是 ______
;下列措施中,可以使平衡向右移动的是 ______ ![]() 选填序号
选填序号![]() 。
。
a.使用催化剂 b.增大压强 c.减小压强 d.升高温度