题目内容
19.下列金属的冶炼原理中,属于热还原法的是( )| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2 | B. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$ 3Fe+4CO2 | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2NaCl(熔融)$\frac{\underline{\;高温\;}}{\;}$ 2Na+Cl2↑ |
分析 热还原法指的是用C、H2、CO或Al做还原剂,在高温条件下通过氧化还原反应来冶炼金属的反应,Zn、Fe、Sn、Pb、Cu等适用热还原法,据此分析.
解答 解:A、此为Hg的冶炼方法,为热分解法,故A错误;
B、此反应为用CO做还原剂来将Fe3O4还原为铁单质的反应,为热还原法,故B正确;
C、此反应为在溶液中铁将铜置换出,为湿法炼铜,故C错误;
D、此反应为电解熔融的氯化钠来冶炼金属钠,为电解法,故D错误.
故选B.
点评 本题考查了金属的冶炼方法,应注意根据金属活动性顺序表,金属的冶炼分为电解法、热还原法和热分解法,难度不大.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
9.X、Y、Z均为中学化学常见物质,在一定条件下,X能与强酸或强碱溶液发生如图的反应(部分反应物、生成物及反应条件略去).则下列说法不正确的是( )


| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y一定是CO2 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
7.下列说法中,错误的是( )
| A. | 化学反应中,有放热反应也有吸热反应 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是吸热反应 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
14.下列物质中,不属于混合物的是( )
| A. | 氯水 | B. | 漂白粉 | C. | 液氨 | D. | 黄铜 |
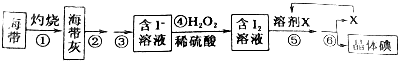

 ”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
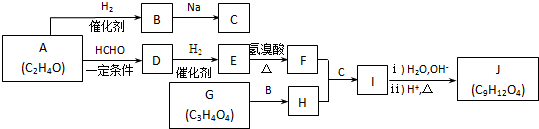
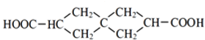 .J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有2种,写出其中一种的结构简式
.J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有2种,写出其中一种的结构简式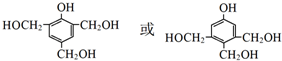 .
. .实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.
.实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.