题目内容
9.X、Y、Z均为中学化学常见物质,在一定条件下,X能与强酸或强碱溶液发生如图的反应(部分反应物、生成物及反应条件略去).则下列说法不正确的是( )
| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y一定是CO2 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
分析 A.Al能与强酸、强碱反应生成氢气;
B.若X为盐,能与强酸、强碱反应生成气体,则X为弱酸形成的铵盐,X可以为碳酸铵、亚硫酸氢铵、硫化铵等;
C.若X为盐,能与碱反应生成气体Z,则Z为氨气;
D.若X为盐,能与强酸、强碱反应生成气体,则X为弱酸的铵盐,可能为碳酸铵、亚硫酸铵、硫化铵.
解答 解:A.X为Al,能与强酸、强碱反应生成氢气,故A正确;
B.若X为盐,能与强酸、强碱反应生成气体,则X为弱酸形成的铵盐,X可以为碳酸铵、亚硫酸氢铵、硫化铵等,则Y可能为二氧化碳、二氧化硫或硫化氢,故B错误;
C.若X为盐,能与碱反应生成气体Z,则Z为氨气,氨气能使湿润的红色石蕊试纸变蓝,故C正确;
D.若X为盐,能与强酸、强碱反应生成气体,则X为弱酸的铵盐,可能为碳酸铵、亚硫酸铵、硫化铵,溶液中铵根离子、弱酸的酸根离子水解,促进水解的电离,其水溶液中水的电离程度比同温度下纯水的电离程度大,故D正确,
故选B.
点评 本题考查无机物推断,需要学生熟练掌握元素化合物性质,注意归纳能与酸、碱的反应的物质,难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
19.常温下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3.H2O)=1×10-4mol•L-1 | |
| B. | CH3COONa溶液中:c(Na+)>c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-1) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①=② |
20.下列各组离子在溶液中能大量共存且溶液为无色透明的是( )
| A. | Ca2+、CO32-、NO3-、K+ | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、NH4+、SO42-、Cl- | D. | Ag+、Al3+、OH-、Cl- |
17.下列有关物质的应用说法正确的是( )
| A. | 生石灰用作食品抗氧化剂 | |
| B. | FeCl3溶液能被铜置换,可用于铜质印刷线路板制作 | |
| C. | 铁红常用作红色油漆和涂料 | |
| D. | 氢氧化钡可作胃酸的中和剂 |
4. 用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )| 选项 | ①中物质 | ②中物质 | 预测①中现象 |
| A | 酚酞溶液 | 浓氨水 | 无色变红色 |
| B | 湿润红布条 | 饱和氯水 | 红布条褪色 |
| C | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
19.下列金属的冶炼原理中,属于热还原法的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2 | B. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$ 3Fe+4CO2 | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2NaCl(熔融)$\frac{\underline{\;高温\;}}{\;}$ 2Na+Cl2↑ |

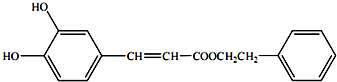
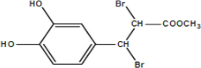
 (或
(或 、
、 )
) .
.