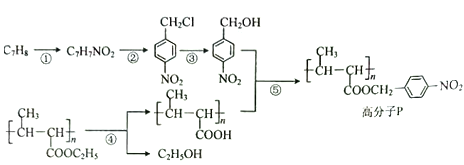
题目内容
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟(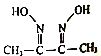 )氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
)氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)写出基态Ni2+的核外电子排布式:___________。
(2)丁二酮肟分子中四种元素电负性由大到小的顺序为_______,该分子中π键和δ键的个数比为______,其中N原子的轨道杂化方式为________。
(3)过量NH3与F2在铜催化作用下反应生成NF3分子。NF3分子的VSEPR模型为_______。
(4)向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,写出此沉淀溶解的离子方程式: ____________。
【答案】 [Ar]3d8 O>N>C>H 2:15 sp2 四面体型 Ni(OH)2+6NH3·H2O=[Ni(NH3)6]2++2OH-+6H2O
【解析】(1)考查电子排布式的书写,Ni的核外电子排布式为[Ar]3d84s2,(2)考查电负性规律、化学键的数目、杂化类型的判断,含有的四种元素是H、C、N、O,同周期从左向右电负性增强,即电负性由大到小的顺序是O>N>C>H;成键原子之间只能形成一个σ键,双键之间有1个σ键和π键,因此个数比为2:15;N有2个σ键,1个孤电子对,因此杂化类型为sp2;(3)VSEPR模型的判断,NF3中N有3个σ键,,孤电子对数为(5-3×1)/2=1,价层电子对数为4,即VSEPR模型为四面体;(4)考查配合物的生成,离子方程式为: Ni(OH)2+6NH3·H2O=[Ni(NH3)6]2++2OH-+6H2O。

练习册系列答案
相关题目