题目内容
(13分)可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。
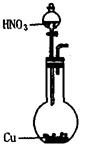
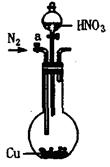

A B C
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择 (填装置序号)。
(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出。
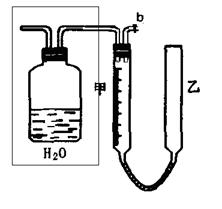
(3)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向C装置的乙管中加适量水;
第二 。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是 。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为n mol,则用含n和V的式子表示m= (结果可不必化简)。



A B C
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择 (填装置序号)。
(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出。

(3)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向C装置的乙管中加适量水;
第二 。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是 。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为n mol,则用含n和V的式子表示m= (结果可不必化简)。
(13分) (1)B(2分)
(2)(2分)
(3)将C中的溶液加适量水稀释(2分)
(4)第二,打开a,通足量N2,排净装置中的空气(2分)
(5)向下移动乙管,使甲、乙两管液面在同一水平面上(2分)
(6)(V-11.2n)/33.6n (3分)
(2)(2分)

(3)将C中的溶液加适量水稀释(2分)
(4)第二,打开a,通足量N2,排净装置中的空气(2分)
(5)向下移动乙管,使甲、乙两管液面在同一水平面上(2分)
(6)(V-11.2n)/33.6n (3分)
略

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目

 试纸去测某氯水的
试纸去测某氯水的 溶液保存在带橡胶塞的玻璃试剂瓶中
溶液保存在带橡胶塞的玻璃试剂瓶中


 (关闭止水夹)
(关闭止水夹)