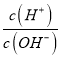题目内容
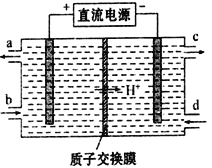
【题目】磷酸铁锂(LiFePO4)电池是一种高效、环保的新型电池,装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐,电池工作时的总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,则下列说法错误的是
Li1-xFePO4+LixC6,则下列说法错误的是
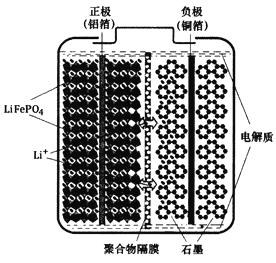
A. 装置中的聚合物隔膜应为阳离子交换膜
B. 充电时,Li+迁移方向为由右向左
C. 充电时,LiFePO4中的铁元素被氧化
D. 放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-=LiFePO4
【答案】B
【解析】A. 电池工作时的总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜,故A正确;B. 充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动,故B错误;C. 电池工作时的总反应为:LiFePO4+6C
Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜,故A正确;B. 充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动,故B错误;C. 电池工作时的总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,充电时,LiFePO4中的铁元素化合价升高被氧化,故C正确;D. 根据A的分析,放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-=LiFePO4,故D正确;故选B。
Li1-xFePO4+LixC6,充电时,LiFePO4中的铁元素化合价升高被氧化,故C正确;D. 根据A的分析,放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-=LiFePO4,故D正确;故选B。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
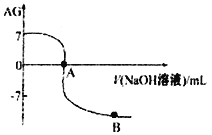
【题目】硫代硫酸钠(Na2S2O3)俗称保险粉,可用作照相定影剂、纸浆漂白脱氯剂等。
实验室可通过反应2Na2S+Na2CO3+4SO2→3Na2S2O3+CO2制取Na2S2O3,装置如图所示。
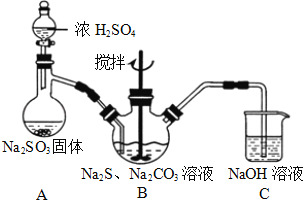
(1)装置B中搅拌器的作用是______;装置C中NaOH溶液的作用是_____。
(2)请对上述装置提出一条优化措施_______________________。
为测定所得保险粉样品中Na2S2O35H2O的质量分数,称取3.000g Na2S2O35H2O样品配成100mL溶液,用0.100mol/L标准碘溶液进行滴定,反应方程式为:2Na2S2O3+I2→2NaI+Na2S4O6
(3)滴定时用__________作指示剂,滴定时使用的主要玻璃仪器有________________。
(4)滴定时,若看到溶液局部变色就停止滴定,则样品中Na2S2O35H2O的质量分数测定值__________(填“偏高”、“偏低”或“不变”)。
(5)某学生小组测得实验数据如下:
实验次数 | 样品溶液体积(ml) | 滴定消耗0.100mol/L碘溶液体积(ml) |
1 | 20.00 | 9.80 |
2 | 20.00 | 10.70 |
3 | 20.00 | 9.90 |
该样品中Na2S2O35H2O的质量分数是_______。(精确到0.001)