题目内容
【题目】雾霾含有大量的污染物SO2、NO,工业上变废为宝利用工业尾气获得NH4NO3 产品的流程图如下(Ce为铈元素):
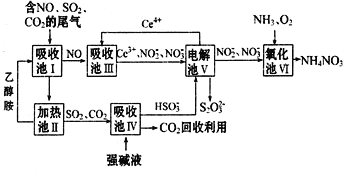
(1)上述流程中循环使用的物质有__________。
(2)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2+H2O![]() HOCH2CH2NH3++OH-,写出足量乙醇胺吸收SO2的化学方程式__________。
HOCH2CH2NH3++OH-,写出足量乙醇胺吸收SO2的化学方程式__________。
(3)写出吸收池Ⅲ中,酸性条件下NO转化为NO3-的离子方程式为___________。
(4)向吸收池Ⅳ得到的HSO3﹣溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,运用平衡移动原理解释溶液pH降低的原因:_____________。(用离子方程式和简要的文字说明)
(5)电解池Ⅴ可使Ce4+再生,装置如下图所示:
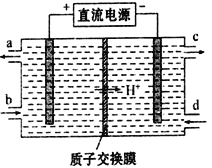
生成Ce4+从__________口(填字母)流出,写出阴极的电极反应式________________________________。
(6)从氧化池Ⅵ中得到粗产品NH4NO3晶体,采用加热蒸干的方法是否合理_______(填“是”或“否”),原因是_____________________(若合理,不填该空)。
【答案】 乙醇胺、Ce4+ 2HOCH2CH2NH2+H2O+SO2=(HOCH2CH2NH3) 2SO3 NO+2H2O+3Ce4+=3Ce3++ NO3-+ 4H+ HSO3-中存在电离平衡HSO3-![]() H++SO32-,加入CaCl2溶液,Ca2++SO32-=CaSO3↓,电离平衡正向移动,c(H+)增大 a 2HSO3-+4H++4e-S2O32-+3H2O 否 NH4NO3高温分解
H++SO32-,加入CaCl2溶液,Ca2++SO32-=CaSO3↓,电离平衡正向移动,c(H+)增大 a 2HSO3-+4H++4e-S2O32-+3H2O 否 NH4NO3高温分解
【解析】吸收池1:2HOCH2CH2NH2+H2O+SO2=(HOCH2CH2NH3) 2SO3,吸收池2:受热分解(HOCH2CH2NH3) 2SO3=2HOCH2CH2NH2+H2O+SO2=(HOCH2CH2NH3) 2SO3,CO2吸收同理,吸改池3:NO+2H2O+3Ce4+=3Ce3++ NO3-+ 4H+ ,吸收池4:OH―+SO2=HSO3―,电解池Ⅴ回收硫:2HSO3-+4H++4e-S2O32-+3H2O ,同时再生Ce4+ ,物质循环使用。(1)上述流程中循环使用的物质有乙醇胺、Ce4+;(2)足量乙醇胺吸收SO2的化学方程式 2HOCH2CH2NH2+H2O+SO2=(HOCH2CH2NH3) 2SO3,(3)吸收池Ⅲ中,酸性条件下,在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO转化为NO3-的离子方程式为NO+2H2O+3Ce4+=3Ce3++ NO3-+ 4H+ ;(4)向吸收池Ⅳ得到的HSO3﹣溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,运用平衡移动原理解释溶液pH降低的原因:NaHSO3溶液中HSO3-的电离大于水解, HSO3-中存在电离平衡HSO3-![]() H++SO32-,加入CaCl2溶液,Ca2++SO32-=CaSO3↓,电离平衡正向移动,c(H+)增大 ;(5)电解池Ⅴ可使Ce4+再生,生成Ce4+从 a 口(填字母)流出; 2HSO3-+4H++4e-S2O32-+3H2O (6)从氧化池Ⅵ中得到粗产品NH4NO3晶体,NH4NO3热稳定性差,采用加热蒸干的方法是否合理:“否”,原因是NH4NO3高温分解。
H++SO32-,加入CaCl2溶液,Ca2++SO32-=CaSO3↓,电离平衡正向移动,c(H+)增大 ;(5)电解池Ⅴ可使Ce4+再生,生成Ce4+从 a 口(填字母)流出; 2HSO3-+4H++4e-S2O32-+3H2O (6)从氧化池Ⅵ中得到粗产品NH4NO3晶体,NH4NO3热稳定性差,采用加热蒸干的方法是否合理:“否”,原因是NH4NO3高温分解。

【题目】在四支试管中发生反应:Mg+2HCl=MgCl2+H2↑,生成H2的速率最大的是( )
试管 | 等质量镁的形状 | 盐酸的浓度 (mol·L-1) | 温度(℃) |
A | 条状 | 0.1 | 30 |
B | 条状 | 0.1 | 40 |
C | 粉末状 | 0.1 | 40 |
D | 粉末状 | 0.5 | 40 |
A. AB. BC. CD. D