题目内容
【题目】溶液的酸碱性可用酸度(AG)表示AG=lg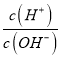 。室温下,某化学兴趣小组的同学用 0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定结果如下图所示,下列有关叙述中正确的是
。室温下,某化学兴趣小组的同学用 0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定结果如下图所示,下列有关叙述中正确的是
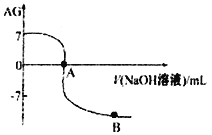
A. 水的电离程度A点小于B点
B. A点时加入的氢氧化钠溶液的体积恰好为20.00 mL
C. 室温0.01 mol·L-1醋酸溶液的电离平衡常数Ka=l0-5
D. 若B点时所加NaOH溶液的体积为40.00 mL,此时溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】C
【解析】A、A点常温时,中性溶液的pH=7,溶液中氢离子浓度等于氢氧根离子浓度,AG=lg1=0,B加碱,抑制水电离,水的电离程度A点大于B点,故A错误;B、A点呈中性,A点时加入的氢氧化钠溶液的体积大于20.00 mL;C、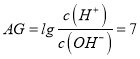 ,得c2(H+ )=10(―14+7)=10-7, 由CH3COOH
,得c2(H+ )=10(―14+7)=10-7, 由CH3COOH![]() CH3COO―+H+ 得Ka=c2(H+ )/C(CH3COOH)=10-7/0.01=l0-5,故C正确;D、若B点时所加NaOH溶液的体积为40.00 mL,溶液相当于等浓度的CH3COONa和NaOH的混合液,CH3COO― 部分水解,浓度比OH― 小,此时溶液中 c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D错误;故选C。
CH3COO―+H+ 得Ka=c2(H+ )/C(CH3COOH)=10-7/0.01=l0-5,故C正确;D、若B点时所加NaOH溶液的体积为40.00 mL,溶液相当于等浓度的CH3COONa和NaOH的混合液,CH3COO― 部分水解,浓度比OH― 小,此时溶液中 c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D错误;故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目