题目内容
13.已知Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ/mol,平衡常数为K;测得在不同温度下,K值如下:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)方程式中的a大于0(填“大于”“小于”或“等于”).
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有BC(填序号)
A.缩小反应器体积 B.通入CO2 C.升高温度到900℃D.使用合适的催化剂.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)由表中数据可知,对于反应,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号;
(3)A、根据该反应为气体体积不变的反应判断;
B.通入CO2 的量,增大反应物浓度,则化学平衡正向移动;
C.升高温度到900℃,化学平衡向吸热方向移动;
D.催化剂只改变反应速率,不改变化学平衡移动.
解答 解:(1)反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数K=$\frac{c(CO)}{c(CO{\;}_{2})}$,故答案为:$\frac{c(CO)}{c(CO{\;}_{2})}$;
(2)由表中数据可知,对于反应,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
故答案为:大于;
(3)A、因为该反应为气体体积不变的反应,所以缩小反应器容积,压强增大,化学平衡不移动,故A错误;
B.通入CO2 的量,增大反应物浓度,则化学平衡正向移动,故B正确;
C.升高温度到900℃,化学平衡向吸热方向即正向移动,故C正确;
D.使用合适的催化剂,不会引起化学平衡的移动,故D错误.
故选BC.
点评 本题考查化学反应平衡常数的表达式以及应用、平衡移动原理等,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
3.常温下,下列各组微粒在指定的溶液中一定大量存在都是( )
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
4.短周期元素A、M、X、Y、Z、E的原子序数依次增大,其元素特征信息如下表
(1)M与X形成的化合物X2M2中含有的化学键为离子键、共价键;X、Y的最高价氧化物对应的水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.(用元素符号表示,下同)
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
(4)X、Y、Z、E四种元素简单离子的离子半径由小到大的顺序是r (Al3+)<r (Na+)<r (Cl-)<r (S2-).
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
| 元素编号 | 元素特征信息 |
| A | 单质是密度最小的气体 |
| M | 其单质为生命活动不可缺少的气体 |
| X | 短周期中原子半径最大的元素 |
| Y | 地壳中含量最高的金属元素 |
| Z | 最外层电子数是最内层电子数的3倍 |
| E | 单质为黄绿色气体 |
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
| 沸点 | 气态氢化物稳定性 | 最高价氧化物 对应水化物的碱性 | 得电子能力 |
| A2M>A2Z | Z< E | X> Y | 16M= 18M |
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
1. 把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
①NaOH粉末;②18mol/L的H2SO4溶液; ③NH4NO3晶体;④Na2O2固体;⑤生石灰.
 把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )①NaOH粉末;②18mol/L的H2SO4溶液; ③NH4NO3晶体;④Na2O2固体;⑤生石灰.
| A. | ①②④⑤ | B. | ①②③ | C. | ②③⑤ | D. | ③④⑤ |
8.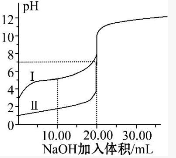 室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00 mL时,QUOTE>1 | |
| C. | 当V(NaOH)=20.00 mL时,两种酸溶液的pH均等于7 | |
| D. | V(NaOH)=20.00 mL时,c(Cl-)<c(CH3COO-) |
18.下列关于气体摩尔体积说法正确的是( )
| A. | 22.4L任何气体,其物质的量均为1mol | |
| B. | 非标准状况下,l mol任何气体体积一定不是22.4L | |
| C. | 0.6mol H2、0.2mo1 O2和0.2mol CO2组成的混合气体在标况下体积约22.4L | |
| D. | 气体摩尔体积指的是在标准状况下1mol气体的体积 |
2.下列现象或应用不能用胶体的知识解释的是( )
| A. | 可吸入颗粒(如硅酸盐粉尘),吸入人体,对人体健康危害极大 | |
| B. | 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 | |
| C. | 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 氯化铝溶液中加入碳酸钠溶液会出现白色沉淀 |
3.下列离子方程式正确的是( )
| A. | 向CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 漂白粉溶液中通入过量SO2:ClOˉ+H2O+SO2═HSO3-+HClO | |
| C. | 在FeSO4溶液中加入H2O2溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | 在澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |