题目内容
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2(s)+ C(s)+ N2(g)![]() Si3N4(s)+ CO(g)
Si3N4(s)+ CO(g)
(1)配平反应中各物质的化学计量数______,已知生成1 mol氮化硅(Si3N4)放出1 591.2 kJ的热量,该反应每转移1 mol e-,放出______kJ的热量。
(2)该反应的平衡常数表达式为K=____。升高温度,其平衡常数______(选填“增大”“减小”或“不变”)。
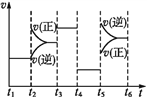
(3)该化学反应速率与反应时间的关系如上图所示,t2时引起v(正)突变、v(逆)渐变的原因是_________,t3引起变化的因素为_________,t5时引起v(逆)大变化、v(正)小变化的原因是_________。
(4)利用右图装置,可以模拟铁的电化学防护。
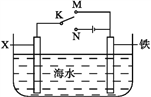
若X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为____________。
【答案】 3SiO2(s)+6C(s)+2N2(g)![]() 1Si3N4(s)+6CO(g) 132.6
1Si3N4(s)+6CO(g) 132.6 ![]() 减小 增大了氮气的浓度 加入(使用)了(正)催化剂 升高温度或缩小容器体积 N 牺牲阳极的阴极保护法
减小 增大了氮气的浓度 加入(使用)了(正)催化剂 升高温度或缩小容器体积 N 牺牲阳极的阴极保护法
【解析】(1)C元素化合价由0价升到+2价,N元素化合价由0价降低到-3价,根据化合价升降守恒,C与N2系数比为6∶2,再通过观察法配平方程式,可得3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)。每生成1 mol Si3N4,转移12mol e-,则每转移1mol e-,放出(1591.2 kJ÷12)= 132.6kJ的热量。
Si3N4(s)+6CO(g)。每生成1 mol Si3N4,转移12mol e-,则每转移1mol e-,放出(1591.2 kJ÷12)= 132.6kJ的热量。
故答案为:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g) ;132.6;
Si3N4(s)+6CO(g) ;132.6;
(2)该反应的平衡常数表达式为:K=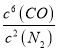 ;该反应为放热反应,升高温度,平衡左移,平衡常数减小。
;该反应为放热反应,升高温度,平衡左移,平衡常数减小。
故答案为:K=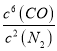 ;减小;
;减小;
(3)t2瞬间,v(正)突然增大,v(逆)没有变化,平衡向正反应方向移动,则t2时增大了反应物的浓度。SiO2和C为固态,改变固体的量对平衡没有影响,则t2时增大了N2的浓度;t3时,v(正)和v(逆)都瞬间增大,而且增得一样多,平衡没有发生移动,则t3时,加入了正催化剂;t5瞬间,v(正)和v(逆)都瞬间增大,且v(逆)>v(正),平衡向逆反应方向移动,则t5时升高温度或缩小了容器的体积。
故答案为:增大了氮气的浓度;加入(使用)了(正)催化剂;升高温度或缩小容器体积;
(4)若X为碳,将开关K置于M处,则构成了原电池装置,铁作负极,碳棒作正极,加速铁的腐蚀;将开关K置于N处,则构成了电解池装置,铁接电源负极为阴极,则铁被保护,减缓了铁的腐蚀。若X为锌,开关置于M处,构成原电池,锌为负极,铁为正极,可减缓铁的腐蚀,该化学防护法称为牺牲阳极的阴极保护法。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】某学习小组设计以下四个实验探究氯水的成分,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
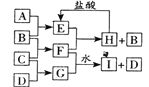
(1)实验①得出的结论__________________________________________。
(2)指出实验②和实验④中的“实验现象”:②_____________;④____________。
(3)实验③中“实验方法”的具体操作过程是:___________________________________。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是a_____________,b._________。请设计简单的实验证明哪一个是正确的_______。