题目内容
2.乙醇分子中各种化学键如图所示,下列有关反应断键位置说明错误的是( )
| A. | 乙醇和乙酸发生酯化反应时断键② | |
| B. | 乙醇和金属钠的反应断键① | |
| C. | 乙醇和浓硫酸,共热到170℃时断键②⑤ | |
| D. | 乙醇在Cu催化作用下与O2反应时断键①③ |
分析 乙醇含有羟基,可发生取代、消去和氧化反应,可与钠反应生成氢气,其中与乙酸发生酯化反应,与钠反应生成氢气时O-H键断裂,发生催化氧化反应生成乙醛,C-H、O-H键断裂,如燃烧,则所有化学键都断裂,以此解答该题.
解答 解:A.和乙酸、浓H2SO4共热生成乙酸乙酯,H-O键断裂,即①键断裂,故A错误;
B.与Na反应生成氢气,O-H键断裂,即①断裂,故B正确;
C.和乙酸、浓H2SO4共热生成乙酸乙酯,H-O键断裂,即①键断裂,故C正确;
D.在Cu作用和O2反应,生成醛,C-H、O-H键断裂,则键①、③断裂,故D正确.
故选A.
点评 本题考查有机物的结构与性质,侧重乙醇性质的考查,注意乙醇的性质与官能团、化学键的关系,注重基础知识的考查,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
9.100mL 0.3mol•L -1K2SO4溶液和100mL 0.2mol•L -1 Al2(SO4)3溶液混合后,溶液中SO42─ 的物质的量浓度为(忽略溶液混合时的体积变化)( )
| A. | 0.30 mol•L -1 | B. | 0.25mol•L -1 | C. | 0.50mol•L -1 | D. | 0.45mol•L -1 |
13.已知A2-核内有x个中子,A原子的质量数为m,则ngA2-所含电子的总物质的量是(单位:mol)( )
| A. | $\frac{m-x+2}{m-n}$ | B. | $\frac{n-(m-x)}{m}$ | C. | $\frac{n(m-x+2)}{m}$ | D. | $\frac{n(m-x+2)}{m}$ |
17.CO2的资源化利用是解决温室效应的重要途径.以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:NH3+CO2→ +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
 +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )| A. | 分子式为C3H3N3O3 | |
| B. | 分子中只含极性键,不含非极性键 | |
| C. | 属于共价化合物 | |
| D. | 该分子中的N原子采用sp杂化、C原子采用sp2杂化 |
7.可用化学方法鉴别NO2和Br2蒸气的是( )
| A. | 淀粉-KI溶液 | B. | AgNO3溶液 | C. | Cl2 | D. | NaOH溶液 |
14.2005年诺贝尔化学奖授予在“烯烃复分解反应”研究方面作出贡献的三位科学家.“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程.如两分子烯烃RCH=CHR′用上述催化剂作用会生成两种新的烯烃RCH=CHR和R′CH=CHR′.把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是( )
| A. | C6H5CH2CH=M | B. | CH2=CH2 | ||
| C. | C6H5CH2CH2C6H5 | D. | C6H5CH2CH=CHCH2C6H5 |
11.在标准状况时,与8g二氧化硫所占体积相同的氧气的质量是( )
| A. | 32g | B. | 16g | C. | 8g | D. | 4g |
12.下列事实不能作为判断依据的是( )
| A. | 硅酸钠溶液中通入SO2产生白色沉淀,判断Si和S的非金属性强弱 | |
| B. | 比较H2O和H2S还原性强弱,判断O和S的非金属性强弱 | |
| C. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| D. | 铁片投入硫酸铜溶液中,铁片上有紫红色物质生成,判断Fe和Cu的金属性强弱 |
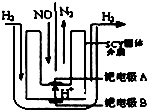 汽车尾气中NOx的消除及无害化处理引起社会广泛关注.
汽车尾气中NOx的消除及无害化处理引起社会广泛关注.