题目内容
【题目】在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
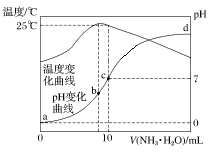
A.a点Kw=1.0×10-14
B.25 ℃时NH4Cl水解常数为(n-1)×10-7 mol·L-1
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.水的电离程度:b>c>a>d
【答案】B
【解析】
A. a点时,温度<25℃,所以Kw<1.0×10-14,A错误;
B. 在c点,c(NH4+)=c(Cl-),c(H+)=c(OH-),NH4Cl水解常数为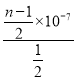 =(n-1)×10-7 mol·L-1,B正确;
=(n-1)×10-7 mol·L-1,B正确;
C. b点时,溶液的成分为NH4Cl、HCl、H2O,所以浓度关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-),C错误;
D. 由C的分析可知,b点溶液显酸性,主要由HCl电离产生,水的电离受到抑制,而c点水的电离不受影响,所以水的电离程度:b<c,D错误。
故选B。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
Ⅰ.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeO(OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是___。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
a | 7.0 | 8.0 | 9.0 |
FeO(OH)的产率 | <50% | 95% | >95% |
FeO(OH)生成后pH | 接近4 | 接近4 | 接近4 |
用离子方程式解释FeO(OH)生成后溶液pH下降的原因:___。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO(OH)向Fe2O3的转化;
ii.溶液中存在少量Fe2+,导致FeO(OH)向Fe2O3的转化。
①分析,假设i不成立的实验依据是___。
②其他条件相同时,向FeO(OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如表:
c(Fe2+)/molL-1 | FeO(OH)百分含量/% | Fe2O3百分含量/% |
0.00 | 100 | 0 |
0.01 | 40 | 60 |
0.02 | 0 | 100 |
以上结果表明:___。
(3)a=7和a=9时,FeO(OH)产率差异很大的原因是___。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO(OH)红棕色悬浊液中同时加入FeSO4溶波和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3
(4)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是___。
②已知N=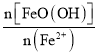 ,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
,其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
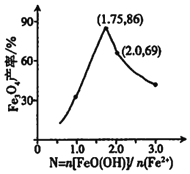
经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___。
【题目】在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________。
(2)该反应为____________反应(选填吸热、放热),原因是_____________________。
(3)能判断该反应是否达到化学平衡状态的依据是________________(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _______________℃。该温度下,若向容器中分别加入2mol H2和2molCO2,10s后达到平衡,则这段时间内υ(H2)=_______________, CO2的转化率为_____________。
【题目】请回答下列问题:
(1)氯化铝水溶液呈________(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示)________________________________________;
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的__________(填化学式)。
(3)已知纯水在T℃时,pH=6,该温度下某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=________mol·L-1。
(4)常温下,浓度均为0.1 mol/L的五种溶液的pH如下表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
根据表中数据,回答问题:
①常温下,等浓度的下列四种酸溶液,pH最小的是______;
A.HCN B.HClO C.H2CO3 D.CH3COOH
②等体积等浓度的NaCN、NaClO两溶液中所含阴、阳离子总数的大小关系为__。
A.前者大 B.相等 C.后者大 D.无法确定