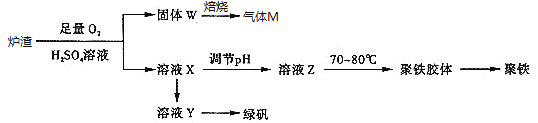
题目内容
【题目】请回答下列问题:
(1)氯化铝水溶液呈________(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示)________________________________________;
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的__________(填化学式)。
(3)已知纯水在T℃时,pH=6,该温度下某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=________mol·L-1。
(4)常温下,浓度均为0.1 mol/L的五种溶液的pH如下表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
根据表中数据,回答问题:
①常温下,等浓度的下列四种酸溶液,pH最小的是______;
A.HCN B.HClO C.H2CO3 D.CH3COOH
②等体积等浓度的NaCN、NaClO两溶液中所含阴、阳离子总数的大小关系为__。
A.前者大 B.相等 C.后者大 D.无法确定
【答案】酸 Al3++3H2O ![]() Al(OH)3+3H+ NaOH 10-12 D C
Al(OH)3+3H+ NaOH 10-12 D C
【解析】
(1)在氯化铝水溶液中,Al3+发生水解,生成H+,由此可推出溶液的性质,原因是铝离子发生水解反应;
(2)硫化钠在溶液中发生水解,生成NaHS和NaOH,为了防止发生水解,可以加入少量的碱。
(3)已知纯水在T℃时,pH=6,该温度下KW=10-6×10-6=10-12。某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=![]() mol·L-1。
mol·L-1。
(4) pH越小,溶液的碱性越弱,对应酸的酸性越强。
①常温下, pH最小,酸性相对最强,等浓度的四种酸溶液,CH3COOH的 pH最小;
②等体积等浓度的NaCN、NaClO两溶液中,发生如下水解:CN-+H2O![]() HCN+OH-,ClO-+H2O
HCN+OH-,ClO-+H2O![]() HClO+OH-,NaCN溶液中c(Na+)+c(CN-)+c(OH-)(水解生成)与NaClO溶液中c(Na+)+c(ClO-)+c(OH-)(水解生成)相等,NaCN的pH大,则表明水解生成的c(OH-)大,水电离产生的c(H+)小,所含阴、阳离子总数小。
HClO+OH-,NaCN溶液中c(Na+)+c(CN-)+c(OH-)(水解生成)与NaClO溶液中c(Na+)+c(ClO-)+c(OH-)(水解生成)相等,NaCN的pH大,则表明水解生成的c(OH-)大,水电离产生的c(H+)小,所含阴、阳离子总数小。
(1)在氯化铝水溶液中,Al3+发生水解,生成H+,由此可推出溶液显酸性,原因是Al3++3H2O ![]() Al(OH)3+3H+;答案为:酸;Al3++3H2O
Al(OH)3+3H+;答案为:酸;Al3++3H2O ![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(2)硫化钠在溶液中发生水解,生成NaHS和NaOH,为了防止发生水解,可以加入少量的NaOH。答案为:NaOH;
(3)已知纯水在T℃时,pH=6,该温度下KW=10-6×10-6=10-12。某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=![]() =10-12mol·L-1。答案为:10-12;
=10-12mol·L-1。答案为:10-12;
(4)pH越小,溶液的碱性越弱,对应酸的酸性越强。
①常温下, pH最小,酸性相对最强,等浓度的四种酸溶液,CH3COOH 的pH最小;答案为:D;
②等体积等浓度的NaCN、NaClO两溶液中,发生如下水解:CN-+H2O![]() HCN+OH-,ClO-+H2O
HCN+OH-,ClO-+H2O![]() HClO+OH-,NaCN溶液中c(Na+)+c(CN-)+c(OH-)(水解生成)与NaClO溶液中c(Na+)+c(ClO-)+c(OH-)(水解生成)相等,NaCN的pH大,则表明水解生成的c(OH-)大,水电离产生的c(H+)小,所含阴、阳离子总数小。答案为:C。
HClO+OH-,NaCN溶液中c(Na+)+c(CN-)+c(OH-)(水解生成)与NaClO溶液中c(Na+)+c(ClO-)+c(OH-)(水解生成)相等,NaCN的pH大,则表明水解生成的c(OH-)大,水电离产生的c(H+)小,所含阴、阳离子总数小。答案为:C。

【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是( )
Ⅰ.试剂:①KMnO4酸性溶液 ②NaOH溶液 ③饱和Na2CO3溶液 ④H2O ⑤Na ⑥溴水 ⑦Br2的CCl4溶液
Ⅱ.装置:

选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ⑦ | ④ |
A.AB.BC.CD.D