题目内容
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-58kJ/mol
CH3OH(g)+H2O(g) △H=-58kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41kJ/mol
CO(g)+H2O(g) △H=+41kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | a | b | c | d | x |
则x=______。(用含表中字母的代数式表示)
(2)若将lmolCO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
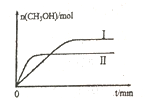
①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>或“=”或“<”)
②一定温度下,能判断该反应达到化学平衡状态的是______。
a.容器中压强不变
b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH)
d.2个C=O断裂的同时有3个H-H形成
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为_____,该温度下的平衡常数为_____,若容器容积不变,下列措施可增加甲醇产率的是____。
a.升高温度 b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
【答案】 1/3(2a+c-b-d)+33 > a,c,d 0.06mol/(L·min) 450 d
【解析】(1)根据盖斯定律有:方程①=方程②-方程③,所以△H1=-58kJ/mol-(+41kJ/mol)=-99 kJ/mol
),又△H1=反应物的总键能-生成物的总键能=(c+2a)-(3x+b+d),所以x= 1/3(2a+c-b-d)+33。
(2) ①、曲线Ⅱ先达到平衡,所以Ⅱ对应的温度比Ⅰ的温度高,对于反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-58KJ/mol来说,降温平衡正向移动,平衡常数增大,即KⅠ>KⅡ。
CH3OH(g)+H2O(g) △H=-58KJ/mol来说,降温平衡正向移动,平衡常数增大,即KⅠ>KⅡ。
②、该反应中气体分子个数前后发生变化,容器中压强不变,说明气体的分子个数不再变化,可以说明反应已达平衡,a正确;如果开始投入的起始原料只有反应物或只有生成物且按化学计量数投料,则反应中甲醇和水蒸气的体积比始终是一个定值,无法说明反应是否平衡,b错误;v逆(H2)=3v逆(CH3OH),若反应已达平衡则有v正(H2)= v逆(H2),所以v正(H2)=3v逆(CH3OH)可说明反应已达平衡,c正确;2个C=O断裂的同时有3个H-H形成,两个速率方向相反,且符合化学计量数之比,可以说明已达平衡,d正确。故能判断该反应达到化学平衡状态的是a,c,d。
③、5min时v(H2)=2mol×0.9÷2L÷5min=0.18 mol/(L·min),所以v(CO2)= v(H2)/3=0.06 mol/(L·min)。利用三段模式方法计算得到平衡时CO2、H2、CH3OH、H2O的浓度分别为:0.2mol/L、0.1mol/L、0.3mol/L、0.3mol/L,所以K=(0.3×0.3)/(0.2×0.13)=450。升温,平衡逆向移动,甲醇产率降低;催化剂不影响平衡的移动,对甲醇的产率无影响;恒容条件下充入He,反应体系中各物质的浓度不变,平衡不移动,对甲醇的产率无影响;按原比例再充入CO2和H2,相当于在等效平衡的基础上增压,平衡正向移动,甲醇的产率增大,故选答案d。

【题目】利用图示装置进行下列实验,能达到实验目的的是
溶液a | 固体b | 溶液c | 实验目的:验证 |
| |
A | 浓硝酸 | NaHCO3 | Na2SiO3 | 非金属性:N>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓盐酸 | CaCO3 | NaAlO2 | 酸性:HCl>H2CO3>Al(OH)3 | |
D | 浓氨水 | CaO | 酚酞溶液 | NH3·H2O是弱碱 |
A. A B. B C. C D. D
【题目】CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
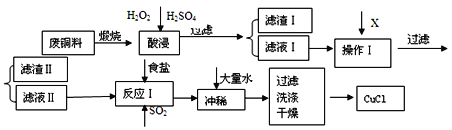
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 5.6 | 6.7 |
Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是:______________________________________。
(2)操作Ⅰ为调节溶液的pH值,范围为___________,加入的物质X可以是_________________________ 。
A.CuO B.Cu(OH)2 C .NaOH 溶液 D.CaCO3
(3)滤渣I的主要成分是________,滤渣Ⅱ的主要成分是_________。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl-,写出反应的离子方程式________________________________________________________________________________________ 。
(5)在反应Ⅰ中,加热并使用浓NaC1溶液,主要目的是_____________________________________________________________________________________ 。