题目内容
(12分)1,2 -二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2 -二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。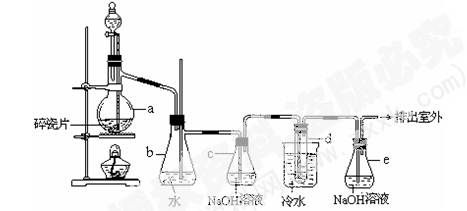
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。_ ;_____________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:____________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因: ______________, _____________________。
(1)C2H5OH 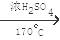 CH2=CH2↑+H2O ,CH2=CH2+Br2
CH2=CH2↑+H2O ,CH2=CH2+Br2 CH2BrCH2Br;(2)b中水面会下降,玻璃管中的水柱会上升,甚至溢出。(3)除去乙烯中带出的酸性气体(或除去CO2、SO2);(4)原因:①乙烯发生速度过快,②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当”亦可)。
CH2BrCH2Br;(2)b中水面会下降,玻璃管中的水柱会上升,甚至溢出。(3)除去乙烯中带出的酸性气体(或除去CO2、SO2);(4)原因:①乙烯发生速度过快,②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当”亦可)。
解析试题分析:(1)题中制备1,2-二溴乙烷的两个化学反应方程式是C2H5OH 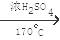 CH2=CH2↑+H2O ,CH2=CH2+Br2
CH2=CH2↑+H2O ,CH2=CH2+Br2 CH2BrCH2Br;(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:b中水面会下降,玻璃管中的水柱会上升,甚至溢出。(3)容器c中NaOH溶液的作用是:除去在制取乙烯的气体中产生的带出的酸性气体(或除去CO2、SO2);(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因有:①乙烯发生速度过快,②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃,发生了副反应而消耗乙醇,使其量增大。
CH2BrCH2Br;(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:b中水面会下降,玻璃管中的水柱会上升,甚至溢出。(3)容器c中NaOH溶液的作用是:除去在制取乙烯的气体中产生的带出的酸性气体(或除去CO2、SO2);(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因有:①乙烯发生速度过快,②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃,发生了副反应而消耗乙醇,使其量增大。
考点:考查乙烯的实验室制取原理、操作、现象、性质及误差分析的知识。

工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下: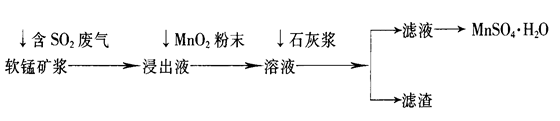
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。
(2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。
(3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。
(4)滤渣的主要成分是________________________________________________(用化学式表示)。
氮化铝(AlN)是一种新型无机材料。某氮化铝(AlN)仅含有Al2O3杂质,某学习小组为测定该氮化铝样品中AlN的纯度,查阅资料得知:AlN + NaOH + 3H2O = Na[Al(OH)4] + NH3↑。设计如下2种方案。
方案一:量气法——如图所示。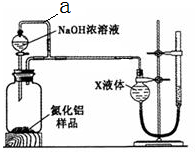
(1)按图连接好装置,检查装置气密性的方法是 。
(2) 导管a的主要作用是 。
(3)为测定生成气体的体积,量气装置中的X液体可以是: 。(填标号)
| A.CCl4 | B.H2O | C.NH4Cl溶液 | D.植物油 |
方案二:重量法——如下图所示。
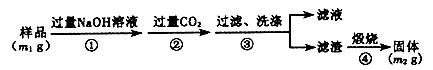
(5) 步骤①中,氧化铝与氢氧化钠溶液反应的离子方程式为_______________。
(6) 样品中AlN的纯度为___________。
(7) 若测得样品中AlN的纯度偏高,可能的原因是___________。(写1点)
某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。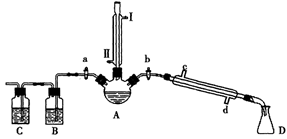
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);竖直冷凝管的主要作用是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液。
B装置检验的物质是_________,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭_______,打开_______;
④接通冷凝管的冷凝水,使冷水从______处流入;
⑤迅速升高温度至_______℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)

 + 2KMnO4
+ 2KMnO4
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O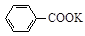 + HCl
+ HCl
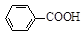 +KCl
+KCl

