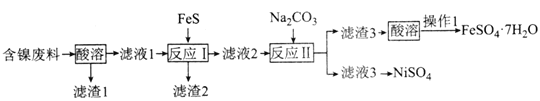
题目内容
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
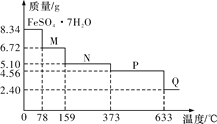
A. 温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B. 取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4
C. 在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D. 温度为159 ℃时固体N的化学式为FeSO4·2H2O
【答案】C
【解析】
8.34 g FeSO4·7H2O 样品的物质的量为8.34 g÷278 g/mol=0.03 mol,其中m(H2O)=0.03 mol×7×18 g/mol=3.78 g,如晶体失去全部结晶水,固体的质量应为8.34 g-3.78 g=4.56 g,可知在加热到373℃之前,晶体失去部分结晶水,据此回答。
A.温度为78 ℃时,固体质量为6.72 g,其中m(FeSO4)=0.03 mol×152 g/mol=4.56 g,m(H2O)=6.72 g-4.56 g=2.16 g,n(H2O)=2.16 g÷18 g/mol=0.12 mol,则n(H2O)∶n(FeSO4)=0.12 mol∶0.03 mol=4∶1,则化学式为FeSO4·4H2O,A项错误;
B.加热至650 ℃时,固体的质量为2.40 g,其中n(Fe)=n(FeSO4·7H2O)=0.03 mol,m(Fe)=0.03 mol×56 g/mol=1.68 g,则固体中m(O)=2.40 g-1.68 g=0.72 g,n(O)=0.72 g÷16 g/mol=0.045 mol,则n(Fe)∶n(O)=0.03 mol∶0.045 mol=2∶3,则固体物质Q的化学式为Fe2O3,B项错误;
C.固体N的质量为5.10 g,其中m(FeSO4)=0.03 mol×152 g/mol=4.56 g,m(H2O)=5.10 g-4.56 g=0.54 g,n(H2O)=0.54 g÷18 g/mol=0.03 mol,则n(H2O)∶n(FeSO4)=0.03 mol∶0.03 mol=1∶1,则N的化学式为FeSO4·H2O,P的化学式为FeSO4,则在隔绝空气条件下由N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O,C项正确;
FeSO4+H2O,C项正确;
D.温度为159℃时,由C项可知N的化学式为FeSO4·H2O,D项错误。
故选C。

 亮点激活精编提优100分大试卷系列答案
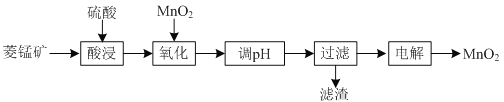
亮点激活精编提优100分大试卷系列答案【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。
【题目】参考下列图表和有关要求回答问题:
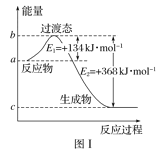
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
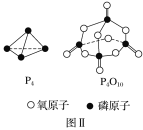
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
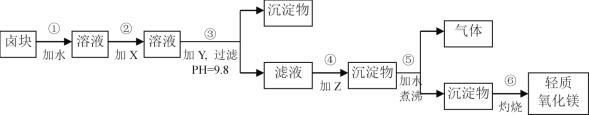
表1
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽
表2
物质 | 价格(元/吨) |
漂白液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,回答下列问题:
(1)步骤②中加入的试剂X,最佳选择_____________(填物质名称),其作用是___________________。
(2)步骤③生成的沉淀物含有____________________(填化学式)。
(3)步骤⑤中发生反应的化学方程式为_____________________________。
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、________和泥三角。
(5)在实验室中,为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是____________(填字母)。
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3