题目内容
20.2008年世界环境日的主题是“戒除嗜好,走向低碳经济”,用碱液吸收CO2可减轻大气污染.用1L 1.0mol-1NaOH溶液吸收0.8mol CO2,所得溶液中CO32-和HCO3-的浓度之比为( )| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
分析 n(NaOH)=1.0mol/L×1L=1mol,如果NaOH完全转化为NaHCO3,则需要n(CO2)=n(NaOH)=1mol,如果完全转化为Na2CO3,则需要n(CO2)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×1mol=0.5mol,实际上二氧化碳物质的量介于二者之间,所以生成物中含有碳酸钠、碳酸氢钠,根据C、Na原子守恒进行计算.
解答 解:n(NaOH)=1.0mol/L×1L=1mol,如果NaOH完全转化为NaHCO3,则需要n(CO2)=n(NaOH)=1mol,如果完全转化为Na2CO3,则需要n(CO2)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×1mol=0.5mol,实际上二氧化碳物质的量介于二者之间,所以生成物中含有碳酸钠、碳酸氢钠,
设溶液中CO32-和HCO3-的物质的量分别是xmol、ymol,根据C、Na原子守恒得:
$\left\{\begin{array}{l}{x+y=0.8}\\{2x+y=1}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.2}\\{y=0.6}\end{array}\right.$,
溶液溶液中不同微粒的物质的量之比等于其浓度之比,所以溶液中CO32-和HCO3-的浓度之比=n(CO32-):n(HCO3-)=0.2mol:0.6mol=1:3,故选A.
点评 本题考查混合物的有关计算,为高频考点,侧重考查学生分析计算能力,注意:如果反应物的物质的量都是已知量,要考虑过量计算,注意原子守恒的应用,题目难度不大.

练习册系列答案
相关题目
10.某温度下,某溶液中c(H+)=10-6 mol/L.则该溶液显( )
| A. | 酸性 | B. | 酸性或中性 | C. | 碱性 | D. | 无法判断 |
11.一定质量的某种有机物和足量金属钠反应,得到VA L气体,相同质量的该有机物与足量Na2CO3溶液反应,可得VB L气体,已知同温同压下VA≠VB.则该有机物可能是( )
| A. | CH3CH(OH)COOH | B. |  | ||
| C. | CH3CH2COOH | D. | HOOC-COOH |
8.H2和Cl2的混合气体a L点燃发生反应后,将气体通入含b mol NaOH的热溶液中,气体恰好与NaOH完全反应,生成NaCl,NaCIO和NaClO3.原混合气体中所含Cl2的物质的量为( )
| A. | $\frac{a}{2}$mol | B. | $\frac{b}{2}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | 无法确定 |
15.下列实验操作正确的是( )
| A. | 将氯气溶于水,须通入倒置并边缘没入水中的漏斗 | |
| B. | 粉碎结块的硝酸铵,可将药品放入研体中轻轻敲碎 | |
| C. | 洗涤做过银镜反应的试管,先用浓硝酸洗涤,再用自来水冲洗 | |
| D. | 玻璃导管与橡皮导管连接,可使玻璃导管蘸水后边旋转边插入橡皮导管 |
9.下列叙述正确的是( )
| A. | 检验某稀溶液中是否含有NO3-,可先将溶液浓缩,然后加入浓H2SO4和铜片,观察有无红棕色气体产生 | |
| B. | 鉴别NO2和溴蒸气可用AgNO3溶液,也可用湿润的淀粉-KI试纸 | |
| C. | 除去NO中的NO2气体,可通入氧气 | |
| D. | 检验溶液中是否含有NH4+,可加入足量NaOH溶液,加热,再将湿润的红色石蕊试纸伸入试管,观察试纸是否变蓝 |
16.已知苯、溴和溴苯的物理性质如下表所示
下图为苯和溴取代反应的改进实验装置.其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑.
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式): .
.
(2)试管C中苯的作用是除去溴化氢中混有的溴蒸汽;反应开始后,观察D试管,看到的现象为石蕊试液变红,并在导管中有白雾产生
(3)在上述整套装置中,具有防倒吸作用的仪器有DEF(填字母).
(4)反应完毕后,将a瓶中的液体取出,经过分液 (填分离操作的名称)可获得获得粗溴苯,向粗溴苯中加入无水CaCl2,其目的是干燥
(5)经以上分离操作后,要进一步提纯粗溴苯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |

填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式):
 .
.(2)试管C中苯的作用是除去溴化氢中混有的溴蒸汽;反应开始后,观察D试管,看到的现象为石蕊试液变红,并在导管中有白雾产生
(3)在上述整套装置中,具有防倒吸作用的仪器有DEF(填字母).
(4)反应完毕后,将a瓶中的液体取出,经过分液 (填分离操作的名称)可获得获得粗溴苯,向粗溴苯中加入无水CaCl2,其目的是干燥
(5)经以上分离操作后,要进一步提纯粗溴苯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
 气化和液化是使煤变成清洁能源的有效途径,煤的气化的主要反应是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,CO和H2的混合气体是合成多种有机物的原料气,研究由CO和H2合成有机物的化学称为一碳化学,如图是合成某些物质的路线图.
气化和液化是使煤变成清洁能源的有效途径,煤的气化的主要反应是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,CO和H2的混合气体是合成多种有机物的原料气,研究由CO和H2合成有机物的化学称为一碳化学,如图是合成某些物质的路线图.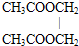 +2H2O;②A→B:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.
+2H2O;②A→B:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.