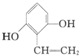
题目内容
13.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | K+不一定存在 | B. | 100 mL溶液中含0.01 mol CO32- | ||
| C. | Cl-可能存在 | D. | Ba2+一定不存在,Mg2+可能存在 |
分析 1、(1)根据题意分析,第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、CO32-、SO42-.
(2)第二份溶液加足量NaOH溶液加热后收集到气体,推得一定含有NH4+,一定不存在Mg2+.
(3)第三份溶液利用发生的离子反应,经过计算、推得一定存在CO32-、SO42-,一定不存在Ba2+;
2、根据溶液中阴阳离子的电荷守恒,即可推出K+一定存在,由K+物质的量的变化分析Cl-的情况.
解答 解:A.根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4↓,因此两者不能共存.Ba2+和CO32-可发生离子反应生成BaCO3↓,因此两者也不能共存.
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-.
第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+.故可确定一定含有NH4+,一定不存在Mg2+.根据反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.
第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为
BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,
因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+.
由条件可知BaSO4为2.33g,物质的量为$\frac{2.33g}{233g/mol}$═0.01mol
BaCO3为6.27g-2.33g═3.94g,物质的量为$\frac{3.94g}{197g/mol}$═0.02mol.
则CO32-物质的量为0.02mol,CO32-物质的量浓度为$\frac{0.02mol}{0.1L}$═0.2mol/L
由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还必须含有Cl-.故A错误;
B.由上述分析可得,100 mL溶液中含CO32-物质的量为0.02mol,故B错误;
C.CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为
0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,
且K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还必须存在Cl-,故C正确;
D.溶液中一定存在CO32-、SO42-、NH4+,Ba2+和CO32-、SO42-,可发生离子反应生成BaCO3↓、BaSO4↓,因此Ba2+一定不存在.同时第二份加足量NaOH溶液加热后,收集到气体,没有产生沉淀,说明一定不含Mg2+,故D错误;
故选:C.
点评 本题考查离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是K+的确定易出现失误.

| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 4℃时,20g2H216O中含有共用电子对数为2NA |
(1)2CH3CHO$→_{①}^{NaOH}$CH3CH(OH)CH2CHO$→_{②}^{-H_{2}O}$CH3CH=CHCH0$\stackrel{③}{→}$CH3CH2CH2CH0
(2)
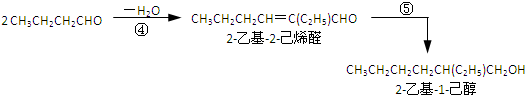
(3)利用邻苯二甲酸酸酐与2-乙基-1-己醇合成DEHP
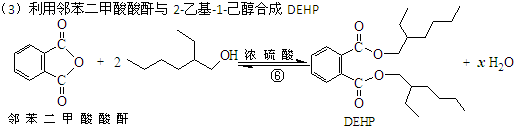
下列说法正确的是( )
| A. | 合成过程涉及加成、消去、酯化、聚合等类型的有机反应 | |
| B. | 步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 | |
| C. | 步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 | |
| D. | ⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |
| A. | 1 | B. | 12 | C. | 16 | D. | 23 |
 气体A是石油裂解的主要产物之一,其相对分子质量为28,C是一中气体,E是一种高分子化合物.A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略)
气体A是石油裂解的主要产物之一,其相对分子质量为28,C是一中气体,E是一种高分子化合物.A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略) (1)合成氨工业对国民经济和社会发展具有重要的 意义.某合成氨工业中氢气由天然气和水反应制备,其主要反应为:CH4(g)+2H2O (g)?CO2(g)+4H2(g)反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
(1)合成氨工业对国民经济和社会发展具有重要的 意义.某合成氨工业中氢气由天然气和水反应制备,其主要反应为:CH4(g)+2H2O (g)?CO2(g)+4H2(g)反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”) =CHCOOCH2CH3)的路线如下:
=CHCOOCH2CH3)的路线如下:
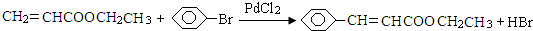


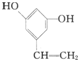
 )与化合物DCH3COOCH2CH3发生反应,可直接合成有机物Q.则D的结构简式为CH3COOCH2CH3,化合物C名称为苯甲醛.
)与化合物DCH3COOCH2CH3发生反应,可直接合成有机物Q.则D的结构简式为CH3COOCH2CH3,化合物C名称为苯甲醛.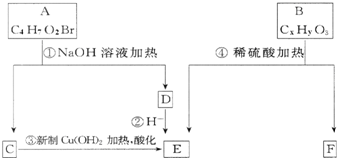 Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化.
Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化. $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
 或
或