题目内容
已除去泥沙的粗盐中,仍含有Mg2+、Ca2+和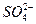 ,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
实验目的:粗盐提纯,得到纯净氯化钠晶体
实验用品:(1)药品:粗盐、NaOH溶液、HCl溶液、Na2CO3溶液、BaCl2溶液、pH试纸和蒸馏水。
(2)仪器:略
(不必叙述如何组装实验装置)实验问题讨论
(1)甲同学在多次过滤后,发现烧杯中的滤液仍浑浊,分析他的操作不当的原因可能是:
①_______________________________________________________________________。
②______________________________________________________________________。
(2)乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体溶于水滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是____________________。
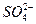 ,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。| ① | 溶解 | 将粗盐放入烧杯中,加入适量的蒸馏水,充分搅拌,直至固体全部溶解 |
| ② | 沉淀 | 逐渐加入氢氧化钠溶液,直至不再出现沉淀为止 |
| ③ | | |
| ④ | | |
| ⑤ | 过滤 | 安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤 |
| ⑥ | | |
| ⑦ | | |
实验用品:(1)药品:粗盐、NaOH溶液、HCl溶液、Na2CO3溶液、BaCl2溶液、pH试纸和蒸馏水。
(2)仪器:略
(不必叙述如何组装实验装置)实验问题讨论
(1)甲同学在多次过滤后,发现烧杯中的滤液仍浑浊,分析他的操作不当的原因可能是:
①_______________________________________________________________________。
②______________________________________________________________________。
(2)乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体溶于水滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是____________________。
| ③ | 沉淀 | 逐渐加入氯化钡溶液,直至不再出现沉淀为止 |
| ④ | 沉淀 | 逐渐加入碳酸钠溶液,直至不再出现沉淀为止 |
| ⑥ | 调节pH | ⑤的滤液中滴加适量盐酸,用玻璃棒蘸取⑤的滤液,点在pH试纸上,与比色板对照,至使pH≤7 |
| ⑦ | 蒸发 | 将⑥烧杯中的澄清液体倒入蒸发皿中,用酒精灯加热,同时用玻璃棒不断搅拌液体,待蒸发皿中出现较多量固体时,停止加热,利用蒸发皿的余热将其蒸干 |
②悬浊液沿玻璃棒加入过滤器中时,将单层滤纸捅破
(2)加入试剂的顺序不合理,③与④顺序颠倒;先滴加足量碳酸钠溶液(除去钙离子),再加足量氯化钡溶液除去硫酸根离子,致使最后溶液仍留有钡离子
此题考查物质分离和提纯的同时考查了实验设计和评价能力及对实验结果的分析能力。除去粗盐中的Mg2+、Ca2+和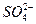 可分别用NaOH、Na2CO3、BaCl2溶液,为了保证除干净,试剂均应过量。加入Na2CO3产生的新杂质离子
可分别用NaOH、Na2CO3、BaCl2溶液,为了保证除干净,试剂均应过量。加入Na2CO3产生的新杂质离子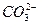 用盐酸除去;加入BaCl2产生的新杂质离子Ba2+用Na2CO3除去,所以Na2CO3应当放在BaCl2之后加入。若二者的顺序颠倒就会出现乙同学的结果。过滤时应注意漏斗中悬浊液的液面要低于滤纸边缘,否则会使所得滤液浑浊。玻璃棒要靠在三层滤纸处,以防玻璃棒捅破滤纸,否则也会使滤液浑浊,得到甲同学一样的实验结果。
用盐酸除去;加入BaCl2产生的新杂质离子Ba2+用Na2CO3除去,所以Na2CO3应当放在BaCl2之后加入。若二者的顺序颠倒就会出现乙同学的结果。过滤时应注意漏斗中悬浊液的液面要低于滤纸边缘,否则会使所得滤液浑浊。玻璃棒要靠在三层滤纸处,以防玻璃棒捅破滤纸,否则也会使滤液浑浊,得到甲同学一样的实验结果。
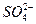 可分别用NaOH、Na2CO3、BaCl2溶液,为了保证除干净,试剂均应过量。加入Na2CO3产生的新杂质离子
可分别用NaOH、Na2CO3、BaCl2溶液,为了保证除干净,试剂均应过量。加入Na2CO3产生的新杂质离子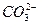 用盐酸除去;加入BaCl2产生的新杂质离子Ba2+用Na2CO3除去,所以Na2CO3应当放在BaCl2之后加入。若二者的顺序颠倒就会出现乙同学的结果。过滤时应注意漏斗中悬浊液的液面要低于滤纸边缘,否则会使所得滤液浑浊。玻璃棒要靠在三层滤纸处,以防玻璃棒捅破滤纸,否则也会使滤液浑浊,得到甲同学一样的实验结果。
用盐酸除去;加入BaCl2产生的新杂质离子Ba2+用Na2CO3除去,所以Na2CO3应当放在BaCl2之后加入。若二者的顺序颠倒就会出现乙同学的结果。过滤时应注意漏斗中悬浊液的液面要低于滤纸边缘,否则会使所得滤液浑浊。玻璃棒要靠在三层滤纸处,以防玻璃棒捅破滤纸,否则也会使滤液浑浊,得到甲同学一样的实验结果。
练习册系列答案
相关题目
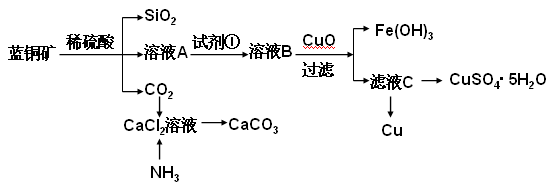
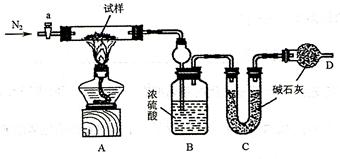
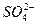 为什么要将原溶液用稀硝酸酸化,用稀盐酸酸化可以吗?哪一个更好?
为什么要将原溶液用稀硝酸酸化,用稀盐酸酸化可以吗?哪一个更好?