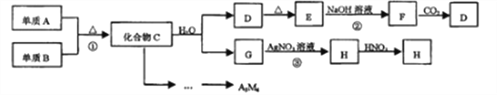
题目内容
【题目】雾霾天气严重影响人们的生活健康,治理污染是化学工作者义不容辞的职责,因而对SO2、NOx等进行研究其有重要意义。
请根据以下信息回答有关问题:
I.NOx是汽车尾气的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
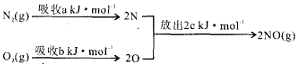
该反应的△H=__________。
(2)科学家通过实验发现,在紫外线照射下TiO2会使空气中的某些分子产生活性基团OH,并且活性基团OH可与NO2、NO发生反应生成硝酸和水。根据左下图示,请写出OH与NO反应的化学方程式__________。
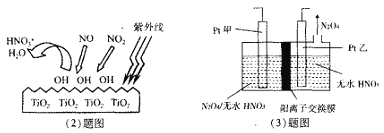
(3)电解法可将工业废气中含有的NO2消除。原理是先将NO2转化为N2O4,然后电解得到N2O5 (常温下为无色固体,常做绿色硝化剂)。电解原理如右上图所示,该电解池中生成N2O5的电极反应式是___________。
Ⅱ.工业上采取多种措施减少SO2的排放。
(4)碘循环工艺具体流程如下:
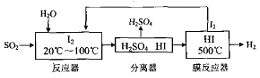
① 用化学方程式表示反应器中发生的反应___________。
② 在HI分解反应中使用膜反应器分离出H2的目的是__________。
③ 该工艺流程的优点有________。
(5)喷雾干燥法脱硫是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,吸收液中c(Ca2+)一直保持为0.70mol/L,则吸收液中的c(SO42-)为_____。[已知该温度下,Ksp (CaSO3)=1.4×10-7]
【答案】 +(a+ b-2c)kJ/mol NO+3OH =HNO3+H2O N2O4 +2HNO3-2e-=2N2O5+2H+ SO2+I2+2H2O=H2SO4+2HI HI的分解为可逆反应,分离出产物H2,有利于反应正向进行 既能吸收SO3降低污染,又能制得氢气和硫酸,反应器中生成的可以循环使用 2.0×10-7mol/L
【解析】I.(1)该反应中的反应热=反应物的键能和-生成物的键能和=(a+b)kJ/mol-2ckJ/mol=+(a+ b-2c)kJ/mol;
(2)由图象可知NO、NO2均被OH氧化为HNO3,依据原子守恒得到,NO+3OH═HNO3+H2O;
(3)N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,因此Pt甲为阳极,pt乙为阴极,阳极反应式为N2O4+2HNO3-2e-=2N2O5+2H+;
Ⅱ.(4)① 从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=H2SO4+2HI;
② 因HI的分解为可逆反应,在HI分解反应中使用膜反应器分离出产物H2,有利于反应正向进行;
③ 该工艺流程的优点有既能吸收SO3降低污染,又能制得氢气和硫酸,反应器中生成的可以循环使用;
(5)C(SO32- )=![]() mol/L=2.0×10-7 mol/L。
mol/L=2.0×10-7 mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】将一定量的H2O(g)和CO(g)分别通入到一体积为2 L的恒容密闭容器中进行反应:H2O(g)+CO(g)CO2(g)+H2(g),得到以下三组数据,据此回答下列问题:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
H2O | CO | H2 | CO | |||
1 | 650℃ | 1 mol | 2 mol | 0.8 mol | 1.2 mol | 5 min |
2 | 900℃ | 0.5 mol | 1 mol | 0.2 mol | 0.8 mol | 3 min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验1中以v(CO2)表示反应速率为_______,以α(CO)表示转化率为_____。
②该反应在650℃时平衡常数数值为_________,该反应的逆反应为_________ (填“吸”或“放”)热反应。
③若实验3和实验2中CO的百分含量相同,且t<3 min,则a、b应满足的关系是_______。
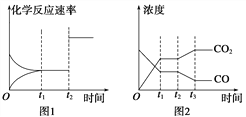
(2)下图1、2表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件可能是____________(写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是______________________________________。
(3)在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2、5.0 mol H2,此时应向________(填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为__________。