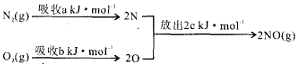
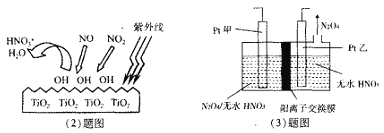
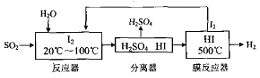
题目内容
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。其中X是原子半径最小的元素,R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物, T与Y 是同一主族元素。

(1)RX4的空间构型_____________,R在元素周期表中的位置_______________。
(2)比较X2Y、X2T稳定性强弱_________________(填化学式)
(3)判断RY2是________化合物(填“离子”或“共价”)写出RY2电子式____________,
(4)写出一个能判断R、T非金属性强弱的化学方程式________________________________。
(5)写出氯碱工业上制取Z、Y、X的离子方程式_________________________________________。
【答案】 正四面体 第二周期第ⅣA族 H2O>H2S 共价 ![]() Na2CO3+H2SO4=Na2SO4+CO2↑+H2O 2Cl-+2H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
【解析】考查元素周期表和元素周期律的应用,X是原子半径最小的元素,即X为H,R原子最外层电子数是电子层数的2倍,可以是C也可以是S,但根据原子序数的大小关系,即R为C,Y与Z可以形成Z2Y和Z2Y2的离子化合物,即Z为Na,Y为O,T与Y是同一主族元素,则T为S,(1)RX4是CH4,空间构型为正四面体,C位于第二周期IVA族;(2)X2Y为H2O,X2T为H2S,非金属性越强,其氢化物越稳定,同主族从上到下非金属性减弱,即稳定性:H2O>H2S;(3)RY2是CO2,属于共价化合物,其电子式为:![]() ;(4)利用它们最高价氧化物的水化物的酸性进行比较,酸性越强,其非金属性越强,即有Na2CO3+H2SO4=Na2SO4+CO2↑+H2O;(5)电解饱和食盐水,其离子反应方程式为:2Cl-+2H2O
;(4)利用它们最高价氧化物的水化物的酸性进行比较,酸性越强,其非金属性越强,即有Na2CO3+H2SO4=Na2SO4+CO2↑+H2O;(5)电解饱和食盐水,其离子反应方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。