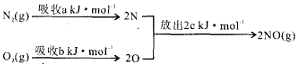
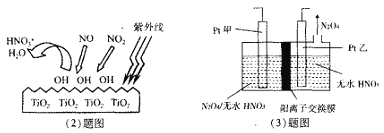
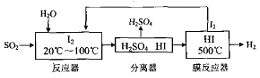
题目内容
【题目】(1)铁与同周期的钙性质有很大的差异,铁的熔点更高,而钙的金属活动性更强,这都说明铁的金属键比钙更_____(选填“强”、“弱”)。与钢铁比,纯净的铁有很强的抗腐蚀性,原因是_______________________。氯化铁受热会发生升华现象,这说明氯化铁是______(选填“离子”、“共价”)化合物。
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),该反应的平衡常数表达式K=_____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是______(选填编号)。
FeO(s)+CO(g),该反应的平衡常数表达式K=_____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
(3)FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-形式存在,请完成该反应的化学方程式。__________
____□FeS2+ □Fe2(SO4)3 +□____→ □FeSO4 +□____
(4)溶液的酸碱性对许多物质的氧化性有很大影响;生成物的溶解性会影响复分解反应的方向。将Na2S溶液滴加到FeCl3溶液中,有单质硫生成; 将FeCl3溶液滴加到Na2S溶液中,生成的是Fe2S3而不是S或Fe(OH)3。从以上反应可得出的结论是______________________。
【答案】 强 不会发生电化学腐蚀 共价 c(CO)/c(CO2) a FeS2+ 7Fe2(SO4)3 +8 H2O→ 15FeSO4 +8 H2SO4 酸性条件氧化性:Fe3+>S 给出Fe3+的能力:Fe(OH)3>Fe2S3
【解析】(1)铁与同周期的钙性质有很大的差异,铁的熔点更高,而钙的金属活动性更强,这都说明铁的金属键比钙更强。由于纯铁不会发生电化学腐蚀,所以与钢铁比,纯净的铁有很强的抗腐蚀性。氯化铁受热会发生升华现象,这说明氯化铁熔沸点较低,是共价化合物。(2)根据方程式可知 该反应的平衡常数表达式K= c(CO)/c(CO2)。a.正反应吸热,升高温度平衡向正反应方向进行,K增大,a正确;b.反应前后体积不变,增大压强平衡不移动,K不变,b错误;c.充入一定量CO,温度不变,K不变,c错误;d.再加入一些铁粉,温度不变,K不变,d错误,答案选a。(3)FeS2中S是-1价,反应后变为+6价,失去7个电子。硫酸铁中铁是+3价,反应后变为+2价,得到1个电子,根据电子得失守恒和原子守恒可知反应的化学方程式为FeS2+ 7Fe2(SO4)3 +8H2O→15FeSO4 +8H2SO4;(4)氯化铁溶液显酸性,将Na2S溶液滴加到FeCl3溶液中,有单质硫生成,这说明酸性条件氧化性:Fe3+>S;将FeCl3溶液滴加到Na2S溶液中,生成的是Fe2S3而不是S或Fe(OH)3,这说明给出Fe3+的能力:Fe(OH)3>Fe2S3。

 优加精卷系列答案
优加精卷系列答案