题目内容
【题目】将一定量的H2O(g)和CO(g)分别通入到一体积为2 L的恒容密闭容器中进行反应:H2O(g)+CO(g)CO2(g)+H2(g),得到以下三组数据,据此回答下列问题:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
H2O | CO | H2 | CO | |||
1 | 650℃ | 1 mol | 2 mol | 0.8 mol | 1.2 mol | 5 min |
2 | 900℃ | 0.5 mol | 1 mol | 0.2 mol | 0.8 mol | 3 min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验1中以v(CO2)表示反应速率为_______,以α(CO)表示转化率为_____。
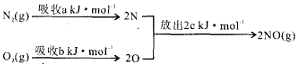
②该反应在650℃时平衡常数数值为_________,该反应的逆反应为_________ (填“吸”或“放”)热反应。
③若实验3和实验2中CO的百分含量相同,且t<3 min,则a、b应满足的关系是_______。
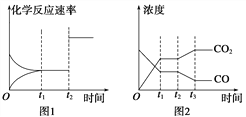
(2)下图1、2表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件可能是____________(写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是______________________________________。
(3)在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2、5.0 mol H2,此时应向________(填“正反应”或“逆反应”)方向进行,平衡时CO2的物质的量为__________。
【答案】(1)①0.16mol/(Lmin)②2.67;吸;③b=2a,a>0.5(或使用催化剂).(2)①加入催化剂或缩小容器体积②通H2O(g)或降温或减小H2浓度(3)逆反应,0.8mol
【解析】(1)①根据方程式可知v(CO)=v(CO2),则v(CO2)=v(CO)= =0.16mol/(Lmin),故答案为:0.16mol/(Lmin);
=0.16mol/(Lmin),故答案为:0.16mol/(Lmin);
②H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
转化 0.8mol/L 0.8mol/l 0.8mol/l 0.8mol/l
平衡 0.2mol/L 1.2mol/L 0.8mol/l 0.8mol/l
根据K=![]() 计算可得该反应在650℃时平衡常数数值为K=
计算可得该反应在650℃时平衡常数数值为K=![]() =
=![]() =2.67,实验1中CO的转化率为
=2.67,实验1中CO的转化率为![]() ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为![]() ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,逆反应为吸热反应;
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,逆反应为吸热反应;
③反应前后气体体积不变,实验2相似的平衡状态(即各物质的质量分数分别相等),为等效平衡,满足CO(g)与H2O(g)的物质的量为1:2,即a:b=1:2,b=2a,由于到达平衡时间t<3min,所以速率较实验2快,故a>0.5(或使用催化剂).
(2)①图1中,t2正逆反应速率同时同等程度增大,由于反应前后气体物质的量相同,增大压强化学平衡不发生移动,即正逆反应速率变化程度相同,所以外界条件的改变为加入催化剂或缩小容器体积,故答案为:加入催化剂或缩小容器体积;
②图2中时刻t2CO2浓度增大,CO浓度减小,即化学平衡向右移动,又由于在t2时,二者浓度不变,即压强不变,或者说,不是因为压强变化而导致平衡的移动,只能为温度的影响,或为H2O(g)或H2浓度的影响,所以条件为通H2O(g)或降温或减小H2浓度,故答案为:通H2O(g)或降温或减小H2浓度.
(3)设反应时转化了CO2xmol/L
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始 (mol/L) 3 1 1 5
转化 (mol/L) x x x x
平衡 (mol/L) 3+x 1+x 1﹣x 5﹣x
Qc=![]() =
=![]() =
=![]() >K,所以平衡向逆反应方向进行;
>K,所以平衡向逆反应方向进行;
根据K=![]() =1,可解得x=0.2,所以平衡时CO2的物质的量为(1mol/L﹣0.2mol/L)×1L=0.8mol,故答案为:逆反应,0.8mol;
=1,可解得x=0.2,所以平衡时CO2的物质的量为(1mol/L﹣0.2mol/L)×1L=0.8mol,故答案为:逆反应,0.8mol;

 阅读快车系列答案
阅读快车系列答案