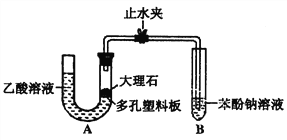
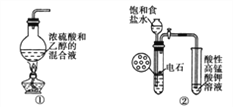
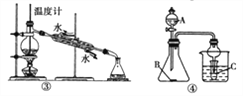
题目内容
【题目】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:

(1)该反应的化学方程式为:______________________________。
(2)反应开始至2min,用Z表示的平均反应速率为:_______________。
(3)下列叙述能说明上述反应达到化学平衡状态的是_________(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2 mol Z
D.混合气体的总质量不随时间的变化而变化
E.恒定容积,混合气体的密度不再发生改变
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g)![]() 2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
①升高温度,反应速率_____________;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率____________。
【答案】 3X + Y![]() 2Z 0.05 mol·L-1·min-1 AB 增大 不变
2Z 0.05 mol·L-1·min-1 AB 增大 不变
【解析】(1)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,化学反应中各物质的物质的量变化量与化学计量数之比呈正比,则有Y:X:Z=(1.0mol-0.9mol):(1.0mol-0.7mol):0.2mol=1:3:2,则反应的化学方程式为3X+Y ![]() 2Z;(2)反应开始至2min,用Z表示的平均反应速率为v=
2Z;(2)反应开始至2min,用Z表示的平均反应速率为v= ![]() =
= ![]() =0.05 mol
=0.05 mol![]() L-1
L-1![]() min-1;(3)A、该反应是气体的物质的量减小的反应,当达到化学平衡时,混合气体的总物质的量不随时间的变化而变化,选项A正确;B、反应前后气体的计量数之和不相等,混合气体的压强不随时间的变化而变化,说明上述反应达到平衡状态,选项B正确;C、无论反应是否平衡,单位时间内每消耗3molX,同时生成2molZ,选项C错误;D、反应遵循质量守恒定律,无论是否平衡,混合气体的总质量不随时间的变化而变化,不能说明上述反应达到平衡状态,选项D错误;E、反应遵循质量守恒定律,无论是否平衡,混合气体的总质量不随时间的变化而变化,而容器体积不变,则密度也不随时间的变化而变化,不能说明上述反应达到平衡状态,选项E错误。答案选AB;(4)根据条件对反应速率的影响,①升高温度,反应速率增大;②保持容器体积不变,充入不参加反应的惰性气体,参与反应的气体物质的浓度不变,反应速率不变。
min-1;(3)A、该反应是气体的物质的量减小的反应,当达到化学平衡时,混合气体的总物质的量不随时间的变化而变化,选项A正确;B、反应前后气体的计量数之和不相等,混合气体的压强不随时间的变化而变化,说明上述反应达到平衡状态,选项B正确;C、无论反应是否平衡,单位时间内每消耗3molX,同时生成2molZ,选项C错误;D、反应遵循质量守恒定律,无论是否平衡,混合气体的总质量不随时间的变化而变化,不能说明上述反应达到平衡状态,选项D错误;E、反应遵循质量守恒定律,无论是否平衡,混合气体的总质量不随时间的变化而变化,而容器体积不变,则密度也不随时间的变化而变化,不能说明上述反应达到平衡状态,选项E错误。答案选AB;(4)根据条件对反应速率的影响,①升高温度,反应速率增大;②保持容器体积不变,充入不参加反应的惰性气体,参与反应的气体物质的浓度不变,反应速率不变。

【题目】(Ⅰ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________________。
(2)某温度下,平衡浓度符合下式: c(CO2)·c(H2)= c(CO)·c(H2O),试判断此时的温度为______℃。
(Ⅱ)在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)== 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D。B的平衡浓度为________, A的转化率为_______,用D表示的平均反应速率为_____。