题目内容
17.现有硫酸和硫酸钠的混合溶液200mL,其中硫酸的浓度为0.4mol•L-1,硫酸钠的浓度为0.5mol•L-1.若使硫酸和硫酸钠的浓度分别为2mol•L-1和0.2mol•L-1,现有98%的密度为1.84g•cm-3的浓硫酸和蒸馏水,配制完成后能得到多少毫升新的混合液?需98%的浓硫酸多少毫升?分析 硫酸钠的物质的量不变,根据稀释定律,计算混合后溶液的体积;
根据混合后硫酸的浓度,结合n=cV计算混合后n(H2SO4),进而计算加入的硫酸的物质的量,根据c=$\frac{1000ρω}{M}$计算98%的H2SO4溶液的物质的量浓度,再根据V=$\frac{n}{c}$计算需要加入的98%的H2SO4溶液的体积.
解答 解:硫酸钠的物质的量不变,根据稀释定律,令混合后溶液的体积为V,则:
200mL×0.5mol•L-1=V×0.2mol•L-1,解得V=500mL
故混合后溶液中n(H2SO4)=0.5L×2mol•L-1=1mol,
故加入的硫酸的物质的量为:1mol-0.2L×0.4mol•L-1=0.92mol,
98%的H2SO4溶液的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故需要加入98%的H2SO4溶液的体积为$\frac{0.92mol}{18.4mol/L}$=0.05L=50mL,
答:配制溶液体积为500毫升,需要加入的98%的H2SO4溶液的体积为50mL.
点评 本题考查物质的量浓度的有关计算,难度中等,根据硫酸钠的物质的量不变计算混合后溶液的体积是关键.

练习册系列答案
相关题目
16.下列液体均处于25℃,有关叙述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的10倍 | |
| C. | AgCl在同浓度的CaCl2的NaCl溶液中的溶解度相同 | |
| D. | 用0.1000mol•L-1NaOH溶液滴定浓度相近的甲酸时,用酚酞做指示剂 |
17.下列有关化学用语表示正确的是( )
| A. | -CHO的电子式: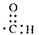 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 顺-1,2-二溴乙烯结构式为: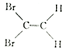 | D. | 丙烷分子的球棍模型: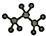 |
5.下列反应中前者属于取代反应,后者属于加成反应的是( )
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体;乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色;乙烯与溴水反应 |
12.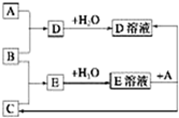 已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )
已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )
 已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )
已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )| A. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物 | |
| B. | A、B、C中有一种金属且为B | |
| C. | 如果E溶液是一种强酸,则E溶液为硫酸 | |
| D. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱 |
2.37Cl是氯的一种同位素,下列说法正确的是( )
| A. | $\frac{1}{40}$mol的1H37Cl分子所含中子数约为3.01×1023 | |
| B. | 37Cl原子所含质子数为20 | |
| C. | 37Cl2气体的摩尔质量为74 | |
| D. | 3.7g37Cl2气体的体积约为22.4L |
9.下列实验操作中正确的是( )
| A. | 用浓硫酸配制稀硫酸时,浓硫酸缓慢加入水中,并用玻璃棒不断搅拌 | |
| B. | 用酒精和汽油都可以萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干再停止加热 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
6.某无色气体可能含有H2S、SO2、CO2、HI、HCl、NO2气体中的一种或几种,将气体通入过量氯水后,得到无色溶液,向该溶液中滴入BaCl2溶液,有白色沉淀生成,则下列叙述正确的是( )
| A. | 该气体中肯定含有SO2 | B. | 该气体中肯定含有H2S和SO2 | ||
| C. | 该气体中肯定含有SO2和CO2 | D. | 该气体中肯定含有H2S、CO2和HI |
7.实验中需2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别( )
| A. | 1000mL,117g | B. | 950mL,111.2 g | C. | 任意规格,117g | D. | 500mL,111.2g |