题目内容
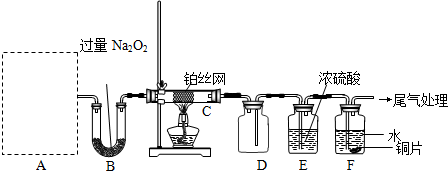
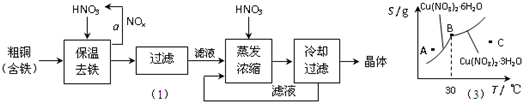
(2009?东城区二模)(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在
不用加水的方法调节溶液pH的原因是
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是
(3)图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2?nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2?3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2?6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
①在步骤a中,还需要通入氧气和水,其目的是
提高原料的利用率,减少污染物的排放
提高原料的利用率,减少污染物的排放
.②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在
3.2~4.7
3.2~4.7
范围.| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
加水会将溶液稀释,不利于将滤液蒸发浓缩
加水会将溶液稀释,不利于将滤液蒸发浓缩
.③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
由于Cu2+发生水解;Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
由于Cu2+发生水解;Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
.(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是
Cu2++2e-=Cu
Cu2++2e-=Cu
.(3)图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2?nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是
b d
b d
(填字母).a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2?3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2?6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是N2O4?NO++NO3-
N2O4?NO++NO3-
;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是Cu+2N2O4=Cu(NO3)2+2NO↑
Cu+2N2O4=Cu(NO3)2+2NO↑
.
分析:(1)①氮氧化物与水和氧气发生氧化还原反应最终生成硝酸;
②Fe3+易水解,为利用溶液的蒸发浓缩,应尽量用浓溶液;
③从影响盐类水解平衡移动的角度分析;
(2)电镀时,镀层金属做阳极,待镀物质做阴极;
(3)分析曲线,处于曲线上的点为饱和溶液状态,根据不同温度所得晶体不同分析;
(4)依据2NH3?NH4++NH2-,类推结合题干信息写出电离方程式;从质量守恒的角度书写反应的化学方程式.
②Fe3+易水解,为利用溶液的蒸发浓缩,应尽量用浓溶液;
③从影响盐类水解平衡移动的角度分析;
(2)电镀时,镀层金属做阳极,待镀物质做阴极;
(3)分析曲线,处于曲线上的点为饱和溶液状态,根据不同温度所得晶体不同分析;
(4)依据2NH3?NH4++NH2-,类推结合题干信息写出电离方程式;从质量守恒的角度书写反应的化学方程式.
解答:解:(1)①氮氧化物与水和氧气发生氧化还原反应最终生成硝酸,在步骤a中,需要通入氧气和水,有利于提高原料的利用率,减少污染物的排放;
故答案为:提高原料的利用率,减少污染物的排放;
②向溶液中加入CuO,调节溶液的pH目的是铁离子全部沉淀,铜离子不沉淀,依据图表数据分析可知PH应为:3.2~4.7;Fe3+易水解,为利用溶液的蒸发浓缩,应尽量用浓溶液,即加水会将溶液稀释,不利于将滤液蒸发浓缩,
故答案为:3.2~4.7;加水会将溶液稀释,不利于将滤液蒸发浓缩;
③硝酸铜溶液中存在:Cu2++2H2O?Cu(OH)2+2H+,进行蒸发浓缩时,要用硝酸调节溶液的pH=1,可以抑制硝酸铜的水解,有利用硝酸铜晶体的析出,
故答案为:由于Cu2+发生水解:Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解;
(2)工业上常利用硝酸铜溶液电镀铜,电镀时,镀层金属做阳极,待镀物质做阴极,阴极的电极反应式是:Cu2++2e-=Cu
故答案为:Cu2++2e-=Cu;
(3)a.处于曲线上的点为饱和溶液状态,A点在曲线上方,应为过饱和溶液,故a错误;
b.B点为生成晶体的转折点,两种晶体可以共存,故b正确;
c.上述流程是在低温下进行的.最终得到的晶体是Cu(NO3)2?6H2O,故c错误;
d.由图象可以看出,溶液降温至30℃以下,可以析出Cu(NO3)2?6H2O晶体,故d正确,
故答案为:b、d;
(4)液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;N2O4?NO++NO3-;Cu与液态N2O4反应制得无水硝酸铜,根据质量守恒和电子守恒可写出反应的化学方程式为Cu+2N2O4=Cu(NO3)2+2NO↑,
故答案为:N2O4?NO++NO3-;Cu+2N2O4=Cu(NO3)2+2NO↑;
故答案为:提高原料的利用率,减少污染物的排放;
②向溶液中加入CuO,调节溶液的pH目的是铁离子全部沉淀,铜离子不沉淀,依据图表数据分析可知PH应为:3.2~4.7;Fe3+易水解,为利用溶液的蒸发浓缩,应尽量用浓溶液,即加水会将溶液稀释,不利于将滤液蒸发浓缩,
故答案为:3.2~4.7;加水会将溶液稀释,不利于将滤液蒸发浓缩;
③硝酸铜溶液中存在:Cu2++2H2O?Cu(OH)2+2H+,进行蒸发浓缩时,要用硝酸调节溶液的pH=1,可以抑制硝酸铜的水解,有利用硝酸铜晶体的析出,
故答案为:由于Cu2+发生水解:Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解;
(2)工业上常利用硝酸铜溶液电镀铜,电镀时,镀层金属做阳极,待镀物质做阴极,阴极的电极反应式是:Cu2++2e-=Cu
故答案为:Cu2++2e-=Cu;
(3)a.处于曲线上的点为饱和溶液状态,A点在曲线上方,应为过饱和溶液,故a错误;
b.B点为生成晶体的转折点,两种晶体可以共存,故b正确;
c.上述流程是在低温下进行的.最终得到的晶体是Cu(NO3)2?6H2O,故c错误;
d.由图象可以看出,溶液降温至30℃以下,可以析出Cu(NO3)2?6H2O晶体,故d正确,
故答案为:b、d;
(4)液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;N2O4?NO++NO3-;Cu与液态N2O4反应制得无水硝酸铜,根据质量守恒和电子守恒可写出反应的化学方程式为Cu+2N2O4=Cu(NO3)2+2NO↑,
故答案为:N2O4?NO++NO3-;Cu+2N2O4=Cu(NO3)2+2NO↑;
点评:本题考查铜以及化合物的性质,题目难度中等,本题注意盐类水解平衡的影响因素,做题时注意把握题给信息,注重知识迁移能力的培养.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
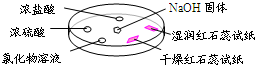 (2009?东城区二模)如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是( )
(2009?东城区二模)如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是( )