题目内容
(2009?东城区二模)下列说法正确的是( )
分析:A、Na2O2中所含阴离子为过氧根离子,阳离子与阴离子之比为2:1;
B、中子数等于质量数减去质子数,由体积和标准状况下计算氧气的物质的量;
C、乙酸中存在3个碳氢共价键,1个碳碳共价键,1个碳氧共价键,1个氧氢共价键,1个碳氧双键,共8对共用电子对;甲酸甲酯中存在4个碳氢共价键,2个碳氧共价单键,1个碳氧双键,共8对共用电子对;
D、氯气与氢氧化钠反应中氯气既是氧化剂又是还原剂,若氯气与稀碱反应,1molCl2反应时转移的电子的物质的量为1mol;若氯气与浓的热碱反应,1molCl2反应时转移的电子的物质的量为5mol.
B、中子数等于质量数减去质子数,由体积和标准状况下计算氧气的物质的量;
C、乙酸中存在3个碳氢共价键,1个碳碳共价键,1个碳氧共价键,1个氧氢共价键,1个碳氧双键,共8对共用电子对;甲酸甲酯中存在4个碳氢共价键,2个碳氧共价单键,1个碳氧双键,共8对共用电子对;
D、氯气与氢氧化钠反应中氯气既是氧化剂又是还原剂,若氯气与稀碱反应,1molCl2反应时转移的电子的物质的量为1mol;若氯气与浓的热碱反应,1molCl2反应时转移的电子的物质的量为5mol.
解答:解:A、过氧化钠的物质的量为
=0.1mol,7.8gNa2O2中所含阴离子的物质的量为0.1mol,其数目为0.1×6.02×1023,故A错误;
B、标准状况下氧气的物质的量为
=0.1mol,0.1mol18O2中所含中子数为0.1mol×2×(18-8)×6.02×1023,即为2×6.02×1023,故B错误;
C、因乙酸中含有8对共用电子对,甲酸甲酯中也含有8对共用电子对,则1mol乙酸和甲酸甲酯的混合物中含共用电子对的数目是8×6.02×1023,故C正确;
D、若用足量NaOH溶液完全吸收1molCl2时生成氯化钠和氯酸钠,则1molCl2反应时转移的电子的物质的量为5mol,故D错误;
故选C.
| 7.8g |
| 78g/mol |
B、标准状况下氧气的物质的量为
| 2.24L |
| 22.4L/mol |
C、因乙酸中含有8对共用电子对,甲酸甲酯中也含有8对共用电子对,则1mol乙酸和甲酸甲酯的混合物中含共用电子对的数目是8×6.02×1023,故C正确;
D、若用足量NaOH溶液完全吸收1molCl2时生成氯化钠和氯酸钠,则1molCl2反应时转移的电子的物质的量为5mol,故D错误;
故选C.
点评:本题考查有关物质的量的简单计算,明确物质的构成、成键情况、质子数与中子数的关系、常见的氧化还原反应中电子的转移即可解答,本题中D项易错.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
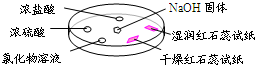 (2009?东城区二模)如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是( )
(2009?东城区二模)如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是( )

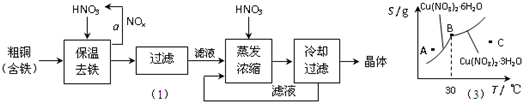
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是