题目内容
(2009?东城区二模)中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是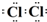
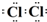 ,该反应的化学方程式是
,该反应的化学方程式是
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是
(1)若Y是黄绿色气体,则Y的电子式是
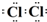
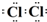
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是
4:1
4:1
.(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是
第4周期Ⅷ族
第4周期Ⅷ族
(填所在周期和族);Y的化学式是NO
NO
.②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是
0.4a
0.4a
mol.(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是
c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)
c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)
.分析:(1)若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:4,结合实验室常用浓盐酸与二氧化锰反应来制取氯气来解答;
(2)A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,若为2个电子层,则第一层电子数为2,第二层电子数为4,即A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,然后利用元素的化合价分析;
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;利用铁的原子序数分析其位置,利用三价铁离子与铁的反应及溶液中两种金属阳离子的物质的量恰好相等来计算被还原的三价铁;
(4)向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有钠元素,A与B按物质的量之比1:4恰好反应,则该反应为氯化铝与氢氧化钠的反应,利用反应中各物质的量级偏铝酸钠的水解来分析.
(2)A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,若为2个电子层,则第一层电子数为2,第二层电子数为4,即A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,然后利用元素的化合价分析;
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;利用铁的原子序数分析其位置,利用三价铁离子与铁的反应及溶液中两种金属阳离子的物质的量恰好相等来计算被还原的三价铁;
(4)向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有钠元素,A与B按物质的量之比1:4恰好反应,则该反应为氯化铝与氢氧化钠的反应,利用反应中各物质的量级偏铝酸钠的水解来分析.
解答:解:(1)因黄绿色气体为氯气,氯原子最外层7个电子,则氯气中存在一对共用电子对,其电子式为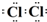 ,A、B的物质的量之比为1:4,
,A、B的物质的量之比为1:4,
则反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为: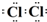 ;MnO2+4HCl(浓)
;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,若为2个电子层,则第一层电子数为2,第二层电子数为4,其质子数等于电子数等于6,即A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,其反应为C+4HNO3═CO2↑+NO2↑+H2O,由化合价可知碳元素的化合价升高,则碳作还原剂,硝酸中氮元素的化合价降低,则硝酸作氧化剂,由化学计量数可知氧化剂与还原剂的物质的量之比为4:1,故答案为:4:1;
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;
①铁为26号元素,在在元素周期表中的第4周期Ⅷ族,铁与稀硝酸反应生成的Y为NO,故答案为:第4周期Ⅷ族;NO;
②设被还原的硝酸铁的物质的量为x,则
2Fe3++Fe═3Fe2+,
2 3
x
由溶液中两种金属阳离子的物质的量恰好相等,则a-x=
,解得x=0.4a,故答案为:0.4a;
(4)向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有钠元素,A与B按物质的量之比1:4恰好反应,则该反应为氯化铝与氢氧化钠的反应,其反应为AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,显然若A与B的物质的量分别为1mol、4mol,则钠离子4mol,氯离子3mol,偏绿酸根离子略小于1mol,因偏铝酸根离子水解则溶液显碱性,即c(OH-)>c(H+),则离子大小为c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+),故答案为:c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+).
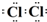 ,A、B的物质的量之比为1:4,
,A、B的物质的量之比为1:4,则反应为MnO2+4HCl(浓)
| ||
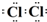 ;MnO2+4HCl(浓)
;MnO2+4HCl(浓)
| ||
(2)A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,若为2个电子层,则第一层电子数为2,第二层电子数为4,其质子数等于电子数等于6,即A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,其反应为C+4HNO3═CO2↑+NO2↑+H2O,由化合价可知碳元素的化合价升高,则碳作还原剂,硝酸中氮元素的化合价降低,则硝酸作氧化剂,由化学计量数可知氧化剂与还原剂的物质的量之比为4:1,故答案为:4:1;
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;
①铁为26号元素,在在元素周期表中的第4周期Ⅷ族,铁与稀硝酸反应生成的Y为NO,故答案为:第4周期Ⅷ族;NO;
②设被还原的硝酸铁的物质的量为x,则
2Fe3++Fe═3Fe2+,
2 3
x
| 3x |
| 2 |
由溶液中两种金属阳离子的物质的量恰好相等,则a-x=
| 3x |
| 2 |
(4)向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有钠元素,A与B按物质的量之比1:4恰好反应,则该反应为氯化铝与氢氧化钠的反应,其反应为AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,显然若A与B的物质的量分别为1mol、4mol,则钠离子4mol,氯离子3mol,偏绿酸根离子略小于1mol,因偏铝酸根离子水解则溶液显碱性,即c(OH-)>c(H+),则离子大小为c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+),故答案为:c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+).
点评:本题较难,考查知识点较多,学生应熟悉常见的氧化还原反应及常见物质的性质是解答本题的关键,并能利用离子方程式或化学反应方程式来分析解答问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
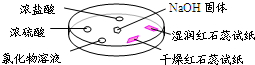 (2009?东城区二模)如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是( )
(2009?东城区二模)如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是( )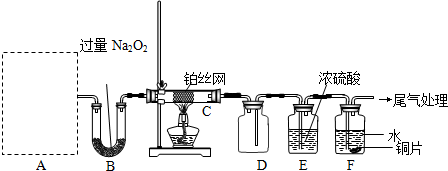
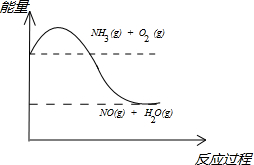
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是