题目内容
【题目】已知有以下物质相互转化,A是生活中用量最大的金属。
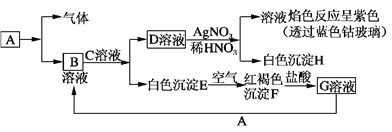
试回答:
(1)写出C的化学式________,H的化学式________。
(2)写出由E转变成F的化学方程式____________________________________。
(3)检验G溶液中的金属阳离子的方法是________________________________。
(4)写出A在一定条件下与水反应的化学方程式_______________________________________。
【答案】 KOH AgCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 取少量待测液于洁净试管中,滴加几滴KSCN溶液,如果溶液变为红色,则G溶液中的金属阳离子为Fe3+ 3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
【解析】A是生活中用量最大的金属,则A为Fe,白色沉淀E在空气中转化为红褐色沉淀F,则E为Fe(OH)2,F为Fe(OH)3;F与盐酸反应得到G溶液,则G为FeCl3;G与A(Fe)生成B,则B为FeCl2;B溶液与C溶液反应生成D溶液和白色沉淀E[Fe(OH)2],则C是碱,D是氯化物;又因为D溶液与硝酸银反应生成溶液和白色沉淀H,则H为AgCl,溶液焰色反应呈紫色(透过蓝色钴玻璃),则溶液中含有K+,所以C为KOH、D为KCl。
(1)由上述分析可得,C的化学式KOH;H的化学式AgCl。
(2)E为Fe(OH)2、F为Fe(OH)3,Fe(OH)2与O2、H2O反应生成Fe(OH)3,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)G为FeCl3,可以用KSCN溶液来检验Fe3+,方法为:取少量待测液于洁净试管中,滴加几滴KSCN溶液,如果溶液变为红色,则溶液中含有Fe3+。
(4)铁在高温时与水蒸气反应生成Fe3O4和氢气,化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
