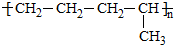��Ŀ����
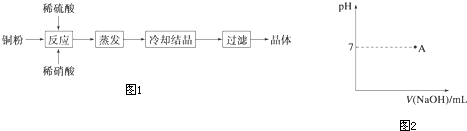
4�����������Ź㷺��Ӧ�ã���1��������CuSO4•5H2O��ʵ�����Ʊ�����ͼ����ͼ1����
�����������������գ�
�������ϣ�Ϊ���Ƶô�����CuSO4•5H2O���壬��Ҫ����ϡ���ᡢϡ�����������ʵ���֮��Ϊ3��2��������Ӧ�����ӷ���ʽΪ3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O��
��ʵ�����������ж�����ϡ�����Ũ�ȿ���Ҫ��Ƚϸߣ�ͨ���ñ�����������Һ���ζ����ζ����������÷�̪��ָʾ�����յ���������Һ����ɫ��ɺ�ɫ����dz��ɫ�����Ұ�����ڲ���ɫ��
������ͼ�л����ζ���������Һ��pH�����μ�����������Һ����ı仯������ͼ����ͼ2����Ҫ���A�㣩��
���ö��Ե缫���һ��Ũ�ȵ�����ͭ��Һ��ͨ��һ��ʱ��������õ���Һ�м���0.1mol Cu2��OH��2CO3��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH��������CO2���ܽ⣩����������й�ת�Ƶ��ӵ����ʵ���Ϊ0.6mol��
��2��Ϊ�ⶨ��Ϸ���K2SO4����NH4��2SO4�мصĺ������������в��裺
�ٳ�ȡ�ص�������������ˮ����������BaCl2��Ba��OH��2��Һ��������ɫ������
�ڹ��ˡ�ϴ�ӡ������������дʵ��������ƣ���
����ȴ�����أ�
������Ϊm g�����������ʵ���Ϊn mol����������K2SO4�����ʵ���Ϊ$\frac{m-132n}{42}$mol���ú�m��n�Ĵ���ʽ��ʾ����
��3��PbSO4������ˮȴ�����ڴ��ᣬ����Ϊ���ܵ�ԭ���Ǣڢۣ�
�ٴ���Ǧ������ˮ���ڴ���Ǧ��������ʡ��۴���Ǧ��ˮ���γɵ���ƽ��ʱ��c��Pb2+��С��PbSO4���ܽ�ƽ���c��Pb2+����������������ᣬ�ʷ�Ӧ�ɽ��У�
���� ��1���������������£������ξ��������ԣ�����������ͭ��������ͭ��һ��������ˮ�����ݷ���ʽ�ж��������������ʵ���֮�ȣ�
�ڸ��ݷ�̪�ı�ɫ��Χ8��10�������յ�ʱ����������Һ����ɫ��ɺ�ɫ����dz��ɫ�����Ұ�����ڲ���ɫ��������������������Һ�ĵμӣ���Һ��pH���������ڽ��յ�ʱpH�ᷢ��ͻ�䣬�ݴ˻����ζ���������Һ��pH�����μ�����������Һ����ı仯������ͼ��
�ۼ�ʽ̼��ͭ��ϡ���ᷴӦ��������ͭ��ˮ�Ͷ�����̼�����Լ���0.1mol��ʽ̼��ͭ[Cu2��OH��2CO3]�൱�ڼ���0.2molCuO��0.1molH2O������������֪��������ͭ���Ӻ������ӷŵ硢���������������ӷŵ磬����ͭ�����������ʵ�����ת�Ƶ���֮��Ĺ�ϵʽ����ת�Ƶ��ӵ����ʵ�����
��2���ٻ�Ϸ����к���K2SO4����NH4��2SO4��Ҫ������ɫ�����������İ�ɫ����Ӧ�������ᱵ���ݴ˷�����
�ڴ���Һ�з������ɫ����Ӧ���ǹ��ˣ����˳��ij�������ͨ��ϴ�Ӻ��
����K2SO4����NH4��2SO4�����ʵ����ֱ���x mol��y mol������������غ���������з�������㣻
��3����������Ǧ��ˮ��Һ������ܽ�ƽ�⣬�������ʱ����������Ӻ�Ǧ��������������ʴ���Ǧ���ٽ�����Ǧ�ܽ⣮
��� �⣺��1���������������£������ξ��������ԣ�����������ͭ����Ӧ�����ӷ���ʽ��3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O�����ݷ���ʽ��֪�������������ʵ�����2mol���������ԭ���غ��֪����������ʵ������ǣ�8mol-2mol����2=3mol�������������������ʵ���֮����3��2��
�ʴ�Ϊ��3��2��3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O��
���������ʹ��̪��ɫ���������ʹ��̪�Ժ�ɫ�������յ�ʱ����������Һ����ɫ��ɺ�ɫ����dz��ɫ�����Ұ�����ڲ���ɫ��������������������Һ�ĵμӣ���Һ��pH���������ڽ��յ�ʱpH�ᷢ��ͻ�䣬������ȷ��ͼ����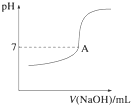 ��
��
�ʴ�Ϊ����Һ����ɫ��ɺ�ɫ����dz��ɫ�����Ұ�����ڲ���ɫ�� ��
��
�ۼ�ʽ̼��ͭ��ϡ���ᷴӦ��������ͭ��ˮ�Ͷ�����̼�����Լ���0.1mol��ʽ̼��ͭ[Cu2��OH��2CO3]�൱�ڼ���0.2molCuO��0.1molH2O������������֪��������ͭ���Ӻ������ӷŵ硢���������������ӷŵ磬����Cuԭ�ӡ�Hԭ���غ������������n��Cu��=0.2mol��n��H2��=0.1mol����ת�Ƶ��ӵ����ʵ���=0.2mol��2+0.1mol��2=0.6mol���ʴ�Ϊ��0.6mol��
��2���ٻ�Ϸ����к���K2SO4����NH4��2SO4��Ҫ������ɫ�����������İ�ɫ����Ӧ�������ᱵ�����Լ�����Լ���BaCl2��Ba��OH��2��
�ʴ�Ϊ��BaCl2��Ba��OH��2��
�ڴ���Һ�з������ɫ����Ӧ���ǹ��ˣ����˳��ij�������ͨ��ϴ�Ӻ������ȷ�IJ����ֱ��ǹ��ˡ�ϴ�ӡ�������ɣ����ʴ�Ϊ�����ˡ�ϴ�ӡ����
����K2SO4����NH4��2SO4�����ʵ����ֱ���x mol��y mol������������غ������������$\left\{\begin{array}{l}{x+y=n}\\{174x+132y=m}\end{array}\right.$�����x=$\frac{m-132n}{42}$���ʴ�Ϊ��$\frac{m-132n}{42}$��
��3������Ǧ��ˮ��Һ������ܽ�ƽ�⣬�������ʱ����������Ӻ�Ǧ��������������ʴ���Ǧ���ٽ�����Ǧ�ܽ⣬���Դ���Ǧ��������ʣ����Ҵ���Ǧ��ˮ���γɵ���ƽ��ʱ��c��Pb2+��С��PbSO4���ܽ�ƽ���c��Pb2+�����ʴ�Ϊ���ڢۣ�
���� ������CuSO4•5H2O��ʵ�����Ʊ�����Ϊ���忼�鷽��ʽ����д�����ζ�ʵ�飬���ԭ���Լ����ʷ����ᴿ�Ȼ�����������ѧ����ȣ���Ŀ�Ѷ��еȣ���Ҫѧ��������ʵ�Ļ���֪ʶ���������֪ʶ��������������

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�| A�� | ��ά�غ͵��۵ķ���ʽ��Ϊ��C6H10O5��n���ʳ���ˮ���IJ��������Ϊn��NA��һ���� | |
| B�� | 1mol��֬����������Ӧ�õ��ĸ�֬�����ƺ��͵ĸ�����Ϊ3��1 | |
| C�� | һ�������£�1mol��Һ��ʯ�������е�������Ӹ�����ΪNA | |
| D�� | 1mol��PX���Զ��ױ�����������KMn04��H+����Ӧ���л���������Ʒ�Ӧ�õ�2mol H2 |
| ���� | ���� | ������g�� | ���ʵ�����mol�� | Ħ��������g/mol�� |
| O2 | 16 | |||
| HNO3 | 6.02��1022 | |||
| NaOH | 0.25 | |||
| Fe2+ | 28 | |||
| MgCl2 | 1.204��1024 |
| A�� | SO2��CaO��CO������������ | |
| B�� | ���ᱵ��ˮ����������� | |
| C�� | ����е�1mol•L-1 NaOH��Һ�еμӱ���FeCl3��Һ�Ʊ�Fe��OH��3���� | |
| D�� | �������֡�ˮ��������ˮ��Ϊ����� |
 ��
��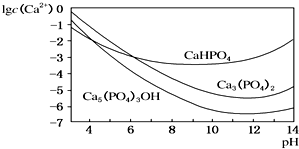 �ǻ���ʯ��һ����Ҫ�����������ϣ��䳣�õ��Ʊ����������֣�
�ǻ���ʯ��һ����Ҫ�����������ϣ��䳣�õ��Ʊ����������֣�