题目内容
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【答案】C
【解析】
锌铜原电池中,负极(Zn):Zn-2e-=Zn2+(氧化), 正极(Cu): Cu2++2e-=Cu(还原),总反应是:Zn+ Cu2+=Zn2++ Cu。
A. 铜电极为正极,正极得电子,发生还原反应,A错误;
B. 阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变, B错误;
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大, C正确;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,阴离子不能通过阳离子交换膜, D错误。
答案选C。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中元素________(填写元素符号)的非金属性最强;元素________(填写元素符号)的金属性最强,写出它与水反应的离子方程式__________________________________。
(2)表中元素③的原子结构示意图是________。
(3)表中元素⑥、⑦氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_________________。
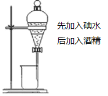
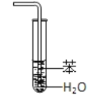
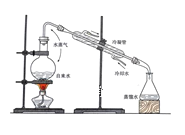
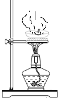
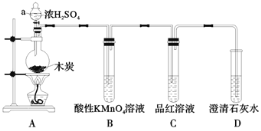
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述正确的是( )
|
|
|
|
① | ② | ③ | ④ |
A.装置①中溶液上层无色,下层紫红色B.装置②可用于吸收HCl气体,并防止倒吸
C.装置③可用于制取蒸馏水D.装置④中液体蒸干后停止加热