题目内容
19.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定.工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅.(1)根据性质,推测氮化硅属于原子晶体.
(2)根据化合价规律,推测氮化硅的化学式为Si3N4.
(3)现用四氯化硅和氮气、氢气加强热反应,可得较高纯度的氮化硅,反应的化学方程式为3SiCl4+2N2+6H2$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl.
分析 (1)原子晶体硬度大,熔沸点高;
(2)N含有7个质子,核外电子排布为K层2个、L层5个电子,原子与硅原子通过共价键结合成原子晶体氮化硅,氮显-3价,硅显+4价,正负化合价代数和为0写出化学式;
(3)根据质量守恒可知四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成.
解答 解:(1)原子晶体硬度大,熔沸点高,根据氮化硅的物理性质:它的硬度大、熔点高、化学性质稳定,可知属于原子晶体,
故答案为:原子;
(2)N含有7个质子,核外电子排布为K层2个、L层5个电子,氮化硅中氮显-3价,硅显+4价,依据化合价代数和为0,可知氮化硅中氮原子数4个,硅原子数3个,化学式为:Si3N4;
故答案为:Si3N4;
(3)四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,可得较高纯度的氮化硅以及氯化氢,方程式为3SiCl4+2N2+6H2$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl,故答案为:3SiCl4+2N2+6H2$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl.
点评 本题主要考查了氮化硅的性质与用途,根据原子的结构和物质的性质解答,方程式书写时,应注意依据原子个数守恒配平,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
10.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO${\;}_{3}^{-}$ | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=5:1时,铝元素以AlO${\;}_{2}^{-}$形式存在 | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在 |
7.在下列氧化还原反应中,水作还原剂的是( )
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$ CO+H2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
8.CoCl2•6H2O是一种饲料营养强化剂.工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2•6H2O的工艺流程如下:
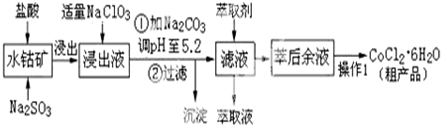
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)水钴矿进行预处理时加入Na2SO3的主要作用是还原Co3+.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(5)萃取剂的作用是除去溶液中的Mn2+;.
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克.则粗产品中CoCl2•6H2O的质量分数是93.0%.

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是还原Co3+.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(5)萃取剂的作用是除去溶液中的Mn2+;.
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克.则粗产品中CoCl2•6H2O的质量分数是93.0%.
5.某合金只含Al、Fe、Cu,为分析其组成,称取ag样品,设计下列实验流程:
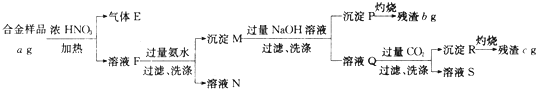
下列相关叙述不正确的是( )

下列相关叙述不正确的是( )
| A. | 气体E呈红棕色,不能直接排放 | |
| B. | 溶液S中所含溶质、沉淀R都可用作药物 | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
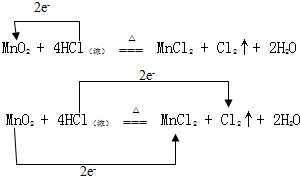 实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O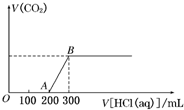 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求:
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求: