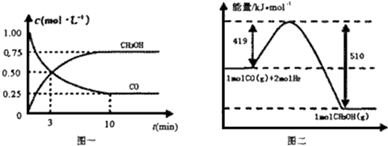
题目内容
20.某溶液中可能含有下列离子:Na+、SO${\;}_{3}^{2-}$、CO${\;}_{3}^{2-}$、NH${\;}_{4}^{+}$、Cl-,分别进行如下实验,根据要求填空.(1)取少量溶液于试管中,加入过量氢氧化钡溶液,无沉促生成,经加热,逸出的气体能够便湿润的红色石蕊试纸变蓝,则原溶液中一定存在的离子是NH4+,一定不存在的离子是SO32-、CO32-.
(2)另取少量原溶液于试管中,加入稀硝酸和硝酸银溶液,有白色沉淀生成,则说明原溶液中一定存在的离子Cl-.
(3)通过上述实验,还无法确定的离子是Na+,为进一步确定其是否存在,需要进行的实验是用焰色反应来鉴别.
分析 (1)取少量溶液于试管中,加入过量氢氧化钡溶液,无沉淀生成,说明溶液中无碳酸根离子和亚硫酸根离子;经加热,逸出的气体能够便湿润的红色石蕊试纸变蓝,说明溶液中存在铵根离子;
(2)另取少量原溶液于试管中,加入稀硝酸和硝酸银溶液,有白色沉淀生成,说明溶液中一定存在氯离子;
(3)通过上述实验,还无法确定的离子是钠离子,金属离子用焰色反应.
解答 解:(1)取少量溶液于试管中,加入过量氢氧化钡溶液,无沉淀生成,说明溶液中无碳酸根离子和亚硫酸根离子;经加热,逸出的气体能够便湿润的红色石蕊试纸变蓝,说明溶液中存在铵根离子,所以原溶液中一定存在的离子是铵根离子,一定不存在的离子是SO32-、CO32-,故答案为:NH4+;SO32-、CO32-;
(2)另取少量原溶液于试管中,加入稀硝酸和硝酸银溶液,有白色沉淀生成,说明溶液中一定存在氯离子,故答案为:Cl-;
(3)通过上述实验,还无法确定的离子是钠离子,金属离子用焰色反应,故答案为:Na+;用焰色反应来鉴别.
点评 本题考查了常见离子的检验,考查物质的检验有:常见阳离子的检验、常见阴离子的检验、常见气体的检验;要注意的是:焰色反应是元素的性质不是单质的性质.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO${\;}_{3}^{-}$ | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=5:1时,铝元素以AlO${\;}_{2}^{-}$形式存在 | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在 |
8.CoCl2•6H2O是一种饲料营养强化剂.工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2•6H2O的工艺流程如下:
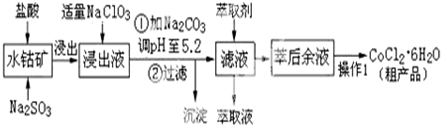
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)水钴矿进行预处理时加入Na2SO3的主要作用是还原Co3+.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(5)萃取剂的作用是除去溶液中的Mn2+;.
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克.则粗产品中CoCl2•6H2O的质量分数是93.0%.

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是还原Co3+.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(5)萃取剂的作用是除去溶液中的Mn2+;.
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克.则粗产品中CoCl2•6H2O的质量分数是93.0%.
5.某合金只含Al、Fe、Cu,为分析其组成,称取ag样品,设计下列实验流程:
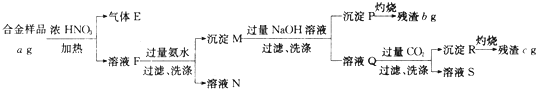
下列相关叙述不正确的是( )

下列相关叙述不正确的是( )
| A. | 气体E呈红棕色,不能直接排放 | |
| B. | 溶液S中所含溶质、沉淀R都可用作药物 | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
6.下列说法或表示方法正确的是( )
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ |