题目内容
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序?????? 。
(2)下列说法错误的是??????? 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物???????? (高或低),
原因是?????????? 。
(4)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为??????? cm。

(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
①F原子的外围电子排布式为________ __。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为??????? (用元素符号表示)。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:该离子中碳原子的杂化方式有?????? 。

(1)C<O<N?? (2)ACD
(3)低??? Fe2+ 半径比Fe3+大,所带电荷也小于Fe3+ ,FeO的晶格能比Fe2O3的小
(4)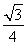 ×
×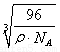
(5)①3d104s1??? 
 ?? ②sp2 sp3
?? ②sp2 sp3
【解析】
试题分析:B元素含有3个能级,且每个能级所含的电子数相同,即1s22s22p2,是C元素;D的原子核外有8个运动状态不同的电子,即8个核外电子,是O元素,推出C是N元素。E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,只有第VIII族与第IB相邻才有此特点,前四周期元素,故E是Fe,F是Cu,Fe基态价电子是3d64s2,3d有4个未成对电子。
(1)C、N、O的第一电离能,N因2p电子半充满稳定而比O大,故是C<O<N;
(2)A中,二氧化硅原子晶体,二氧化碳是分子晶体,所以沸点:SiO2>CO2
C中,N2与CO为等电子体,只是物理性质相似,化学性质相差较大。
D中,水分子间存在氢键是物理性质,稳定性是化学性质,不能判断稳定性H2O>H2S。
(3)FeO熔点低于Fe2O3,因为Fe2+ 半径比Fe3+大,所带电荷也小于Fe3+,FeO的晶格能比Fe2O3的小。
(4)晶体若正方体的棱长是l,晶胞为8g碳原子,ρ=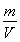 =
=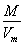 =
=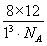 ,l=
,l= ;最近的两个C原子之间的距离为正方体体对角线的
;最近的两个C原子之间的距离为正方体体对角线的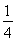 ,则最近的两个C原子之间的距离
,则最近的两个C原子之间的距离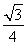 l=
l=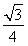 ×
×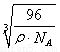 。
。
(5)①由洪特规则,29Cu原子的外围电子排布式为3d104s1。题中给出的[F(N)4]2+是[Cu(NH3)4]2+离子,结构式为
 (共价键也可以用箭头表示,但指向Cu)。
(共价键也可以用箭头表示,但指向Cu)。
②图1中碳原子的杂化方式有sp2(苯环上的C原子)、sp3(甲基中的C原子)。
考点:考查物质结构中的原子、分子、晶体的性质和结构的综合。

 备战中考寒假系列答案
备战中考寒假系列答案 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.






