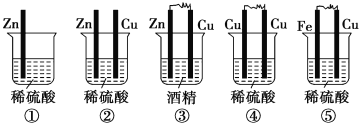
��Ŀ����
����Ŀ������������У�����CuCl��������Һ���ղ������ⶨCO�ĺ������仯ѧ��Ӧ���£�2CuCl+2CO+2H2O��Cu2Cl22CO2H2O���ش��������⣺
(1)Cu��Ԫ�����ڱ�������______(ѡ����s������p������d������ds��)��Ԫ�ء�
(2)C��N��O����ԭ���еĵ�һ������������____________��NO3- ���ӵĿռ乹����______��
(3)CO��N2���Ƶȵ����塣�±�ΪCO��N2���й���Ϣ��
�������� | A-B(����) | A=B(˫��) | A��B(����) | |
����(kJ/mol) | CO | 351 | 803 | 1071 |
N2 | 159 | 418 | 946 | |
���ݱ������ݣ�˵��CO��N2���õ�ԭ����________________________��
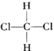
(4)Cu2Cl22CO2H2O��һ��������ṹ��ͼ��ʾ��
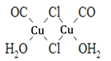
�ٸ����������ԭ�ӵ��ӻ���ʽΪ_________________________��
�ڸ�������У�CO������ʱ��λԭ����C������O��ԭ����______________________��
��1molCu2Cl22CO2H2O���е�______________��������
���𰸡�ds N ƽ�������� CO�е�һ�������ļ��ܱ�N2�ĵ�һ�������ļ���С�ܶ࣬CO�ĵ�һ������������ sp3 �縺�ԣ�C��O��C�Թµ��ӶԵ����������������������µ��Ӷ� 14NA
��������
(1)CuΪ29��Ԫ�أ�λ�ڵ������ڣ��ڢ�B�壬����ds�����ʴ�Ϊ��ds��
(2) C��N��O��λ�ڵڶ�����������������һ������£�ͬ����Ԫ�ش������ң���һ����������N��2p�������������ȶ�������ʧ���ӣ���N�ĵ�һ�����ܱ�O�����ߵĵ���������ΪN��NO3��N�ļ۲���Ӷ���=![]() =3����������Nԭ���ӻ�����Ϊ��sp2�ӻ����µ��Ӷ���=0�����ԣ�NO3Ϊƽ�������Σ��ʴ�Ϊ��N��ƽ�������Σ�
=3����������Nԭ���ӻ�����Ϊ��sp2�ӻ����µ��Ӷ���=0�����ԣ�NO3Ϊƽ�������Σ��ʴ�Ϊ��N��ƽ�������Σ�
(3)CO�е�һ�������ļ��ܱ�N2�ĵ�һ�������ļ���С�ܶ࣬����CO�ĵ�һ���������ϣ�CO��N2���ã��ʴ�Ϊ��CO�е�һ�������ļ��ܱ�N2�ĵ�һ�������ļ���С�ܶ࣬CO�ĵ�һ�����������ѣ�
(4)����ԭ����Cuԭ���γ���2�������������2�Թµ��ӣ�����4���ӻ�������ӻ�����Ϊsp3���ʴ�Ϊ��sp3��
��C�ĵ縺��С��O���Թµ��Ӷ��������������������ӶԸ����ף���CO������ʱ����λԭ����C������O���ʴ�Ϊ���縺�ԣ�C��O��C�Թµ��ӶԵ����������������������µ��Ӷԣ�
���и������Ľṹ��֪��1molCu2Cl22CO2H2O����8mol��λ����4molH-O����2molCO��2mol������H-O������λ����������������1molCu2Cl22CO2H2O����8mol+4mol+2mol=14mol��������14NA���������ʴ�Ϊ��14NA��

 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�