题目内容
【题目】图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
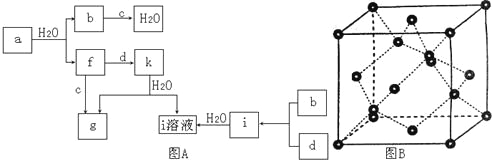
回答下列问题:
(1)图B对应的物质名称是_________,其晶胞中的原子数为______,晶体类型为_______。
(2)d中元素的原子核外电子排布式为_______。
(3)图A中由二种元素组成的物质中,沸点最高的是______,原因是______,该物质的分子构型为_________,中心原子的杂化轨道类型为_________。
(4)图A中的双原子分子中,极性最大的分子是_________。
(5)k的分子式为_________,中心原子的杂化轨道类型为_________,属于_________分子(填“极性”或“非极性”)。
【答案】金刚石 8 原子晶体 1s22s22p63s23p5 H2O H2O分子间形成氢键 V形(或角形) sp3 HCl COCl2 sp2 极性
【解析】
(1)每个a原子周围有4个a—a键,a的该种单质为原子晶体,a能与水反应生成b和f,则图B对应的物质为金刚石;该晶胞中的原子数为:8×![]() +6×
+6×![]() +4=8。
+4=8。
(2)a为C,a、b、c和d分别为四种短周期元素的常见单质,则b为H2、f为CO;b与c反应生成H2O,则c为O2;b与d反应生成i,i的溶液为常见的酸,则d为Cl2,i为HCl;f与c反应生成g,f与d反应生成k,k与水反应生成g和i溶液(HCl水溶液),则g为CO2、k为COCl2;d中元素为Cl,Cl原子核外有17个电子,其排布式为:1s22s22p63s23p5。
(3)图A中由两种元素组成的物质有f为CO、g为CO2、i为HCl、H2O,这四种物质常温下只有水是液态,其它都是气体,故沸点最高的是H2O,原因是H2O分子间形成氢键;H2O中O上的孤电子对为![]() ×(6-2×1)=2,σ键电子对数为2,价层电子对数为4,故O采取sp3杂化,由于有两对孤电子对,故H2O的构型为V形(或角形)。
×(6-2×1)=2,σ键电子对数为2,价层电子对数为4,故O采取sp3杂化,由于有两对孤电子对,故H2O的构型为V形(或角形)。
(4)所有双原子分子有H2、O2、Cl2、HCl、CO,其中H、Cl电负性差值最大,因而极性最大。
(5)k为COCl2;COCl2中C原子含有3个σ键、1个π键,C上没有孤电子对,故C原子采取sp2杂化;COCl2为平面三角形结构,分子中正负电中心不重合,COCl2为极性分子。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列根据实验事实得出的结论正确的是
实验事实 | 结论 | |
A | 某物质在熔融态下能导电 | 该物质一定是电解质 |
B | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
C | SO2的水溶液能导电 | SO2为电解质 |
D | 已知:Cl2+2FeCl2=2FeCl3反应能发生 | 氧化性:Cl2>FeCl3 |
A.AB.BC.CD.D
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
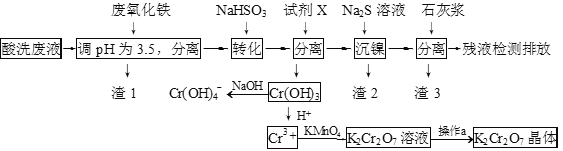
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
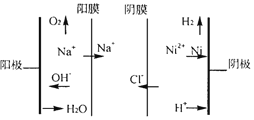
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。
【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ___ |
(2) | 乙炔 | ___ | ___ |
(3)D装置中氢氧化钠溶液的作用___。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯![]() 甲
甲![]() 乙
乙![]() PVC
PVC
(4)甲的结构简式是___;
(5)反应③的化学方程式是__。
(6)下列说法正确的是___。
A.乙烯可以作为植物生长调节剂
B.PVC不能使酸性高锰酸钾溶液褪色
C.PVC中的官能团是碳碳双键和氯原子