题目内容
【题目】如图是500 ℃时, 1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图。若在温度恒定,体积不变的容器中反应达到平衡,再充入NO2则,ΔH________(填“增大”、“减小”或“不变”,下同)。请写出NO2和CO反应的热化学方程式:__________。该反应能自发进行的主要原因为_____________________。

【答案】 不变 NO2(g)+CO(g) 500 ℃CO2(g)+NO(g) ΔH=-234 kJ· mol-1 ΔH<0
【解析】焓变是与化学反应的起始状态、终止状态有关,与物质所处环境的压强、温度等因素有关,与化学反应的过程物质的量多少无关。若在温度恒定,体积不变的容器中反应达到平衡,再充入NO2,ΔH不变;由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g) 500 ℃CO2(g)+NO(g) ΔH=-234 kJ· mol-1;根据ΔG=ΔH-TΔS<0,则反应自发进行,该反应熵变不大,要使ΔH-TΔS<0,,必须ΔH <0,故反应能自发进行的主要原因为ΔH <0。

练习册系列答案
相关题目
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
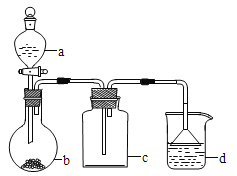
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D