题目内容
19.把8gNaOH固体溶解于105mL水后得到100mL溶液,则该NaOH溶液的物质的量浓度为( )| A. | 2mol•L-1 | B. | 7.8mol•L-1 | C. | 8mol•L-1 | D. | 1.9mol•L-1 |
分析 根据n=$\frac{m}{M}$计算出8g氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出100mL该氢氧化钠溶液的物质的量浓度.
解答 解:8g氢氧化钠的物质的量为:$\frac{8g}{40g/mol}$=0.2mol,
则该氢氧化钠溶液的物质的量浓度为:$\frac{0.2mol}{0.1L}$=2mol/L,
故选A.
点评 本题考查了物质的量浓度的简单计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
9.下列物质在一定条件下不能发生水解反应的是( )
| A. | 蔗糖 | B. | 植物油 | C. | 葡萄糖 | D. | 淀粉 |
10.下列有关物质检验的操作和实验结论都正确的是( )
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 向溶液中加NaOH溶液并加热,将干燥红色石蕊试纸放在试管口,试纸变蓝. | 该溶液中一定含NH4+ |
| A. | A | B. | B | C. | C | D. | D |
7.已知:①2FeCl3+2KI═2FeCl2+2KCl+I2 ②2FeCl2+Cl2═2FeCl3,据此可判断各物质的氧化性由强到弱的顺序是( )
| A. | I2>Cl2>FeCl3 | B. | FeCl3>Cl2>I2 | C. | Cl2>I2>FeCl3 | D. | Cl2>FeCl3>I2 |
4.用NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 0.2NA个CO分子在标准状况下的体积约是4.48 L | |
| B. | 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA | |
| C. | 4℃时,22.4 L水中含有的电子数目为10NA个 | |
| D. | 使23g钠变为 Na+,需失去0.1NA个电子 |
11.下列有机化合物的名称错误的是( )
| A. | 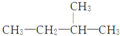 2-甲基丁烷 2-甲基丁烷 | B. |  3-乙基戊烷 3-乙基戊烷 | C. |  2-乙基戊烷 2-乙基戊烷 | D. |  2,3-二甲基丁烷 2,3-二甲基丁烷 |
8.下列对化学反应的认识正确的是( )
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 对一可逆反应,其他条件不变时,升高温度,平衡常数K一定增大 | |
| C. | 化学反应过程中,一定有化学键的断裂和形成 | |
| D. | 放热反应的反应速率,一定比吸热反应的反应速率大 |