题目内容
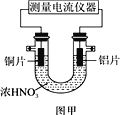
【题目】利用电化学原理还原CO2制取ZnC2O4的装置如图所示(电解液不参加反应),下列说法正确的是

A. 可用H2SO4溶液作电解液
B. 阳离子交换膜的主要作用是增强导电性
C. 工作电路中每流过0.02 mol电子,Zn电极质量减重0.65g
D. Pb电极的电极反应式是2CO2-2e-=C2O42-
【答案】C
【解析】如果用H2SO4溶液作电解液,溶液中氢离子会在正极得电子生成氢气,影响2CO2+2e-=C2O42-反应的发生,A错误;用阳离子交换膜把阳极室和阴极室隔开,它具有选择透过性,它只允许H+透过,其它离子难以透过,B错误;Zn电极为负极,发生氧化反应,Zn-2e-= Zn2+;当电路中每流过0.02 mol电子,消耗锌的量为0.01 mol,质量为0.65g,C正确;Pb电极为正极,发生还原反应,2CO2+2e-=C2O42-,D错误;正确选项C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
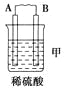
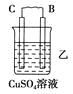
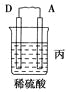
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。