题目内容
【题目】工业合成氨反应具有非常重要的意义。
(1)对可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若起始投料n(N2)∶n(H2)=1∶1,达到平衡后,降低温度,N2的体积分数_____。
2NH3(g) ΔH<0,若起始投料n(N2)∶n(H2)=1∶1,达到平衡后,降低温度,N2的体积分数_____。
A.增大 B.减小 C.不变 D.不能判断
(2)T ℃,以CO2和NH3为原料可合成化肥尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l);在2 L的密闭容器中,通入1.2 mol NH3和0.6 mol CO2,2 min时反应刚好达到平衡,此时c(NH3)=0.2 mol·L-1,c(CO2)=0.1 mol·L-1。
CO(NH2)2(s)+H2O(l);在2 L的密闭容器中,通入1.2 mol NH3和0.6 mol CO2,2 min时反应刚好达到平衡,此时c(NH3)=0.2 mol·L-1,c(CO2)=0.1 mol·L-1。
①T ℃时该反应的平衡常数K=_____。
②若2 min时保持T ℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6 mol NH3,则此时v正____v逆(填“>”“<”或“=”)。
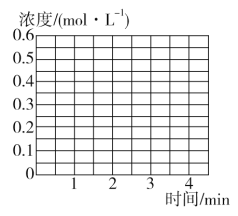
③若保持T ℃,在2 min时把容器体积瞬间压缩到1 L且保持体积不变,3 min时达到新平衡,请在图中画出2 min到3 min内NH3浓度的变化曲线。_______
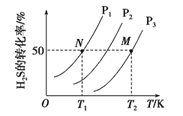
(3)NH3催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(l) ΔH,向容积为2 L的恒容密闭容器中,充入NO2和NH3的混合气体0.14 mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
7N2(g)+12H2O(l) ΔH,向容积为2 L的恒容密闭容器中,充入NO2和NH3的混合气体0.14 mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
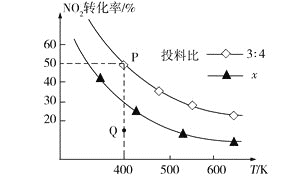
①ΔH____0(填“>”“<”或“=”),理由是_____。
②x_____3∶4(填“>”“<”或“=”),理由是_____。
③400 K时,该反应的平衡常数表达式为____。
④投料比为3∶4时,Q点v逆(NH3)____P点v逆(NH3)(填“>”“<”或“=”)。
【答案】C 250 <  < 升高温度NO2转化率减小平衡逆向移动,所以正反应放热 > 投料比越大NO2的物质的量越大,NO2的转化率越小 c7(N2)/c6(NO2)c8(NH3) <
< 升高温度NO2转化率减小平衡逆向移动,所以正反应放热 > 投料比越大NO2的物质的量越大,NO2的转化率越小 c7(N2)/c6(NO2)c8(NH3) <
【解析】
(1)w(N2)=![]() ×100%=50%,再根据三段式求出反应后氮气的体积分数,前后进行比较;
×100%=50%,再根据三段式求出反应后氮气的体积分数,前后进行比较;
(2)①根据K=![]() 进行计算;
进行计算;
②若保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol NH3,体积瞬间变为4L,此时c(NH3)=0.25molL-1,c(CO2)=0.05molL-1,据此分析浓度商与K的关系进行作答;
③2min时把容器体积瞬间压缩到1L,此时c(NH3)=0.4molL-1,保持T℃不变,平衡常数K不变,则3min平衡时NH3浓度仍为 0.2molL-1,据此进行作图;
(3)①升高温度,平衡向吸热方向移动,根据转化率的变化来判断该反应是放热还是吸热,从而分析焓变;
②结合投料比对NO2转化率的影响效果分析;
③依据平衡常数的定义作答;
④投料比为3∶4时P点达平衡,Q点未达平衡,此时NO2的转化率比平衡时小据此分析作答。
(1)开始w(N2)= ![]() ×100%=50%,设开始氮气,氢气的物质的量分别为1mol,1mol,
×100%=50%,设开始氮气,氢气的物质的量分别为1mol,1mol,
N2(g)+3H2(g)2NH3(g)
初始量110
转化量x3x2x
平衡量1x13x2x,
反应后氮气的体积分数为![]() ×100%=
×100%=![]() ×100%=50%,则N2的体积分数恒为50%,由此可见平衡时N2的体积分数保持不变,故答案为:C;
×100%=50%,则N2的体积分数恒为50%,由此可见平衡时N2的体积分数保持不变,故答案为:C;
(1)① 2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l);
初始量(mol/L)0.60.300
转化量(mol/L)0.4 0.2 0.20.2
平衡量(mol/L)0.2 0.1 0.2
K=![]() =
=![]() =250;
=250;
②若保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6molNH3,体积瞬间变为4L,此时c(NH3)=0.25molL1,c(CO2)=0.05molL1,反应的浓度商Q=10.252×0.05=320,Q>K,所以平衡逆向移动,v正<v逆,
故答案为:<;
③2min时把容器体积瞬间压缩到1L,此时c(NH3)=0.4molL1,保持T℃不变,平衡常数K不变,则3min平衡时NH3浓度仍为0.2molL1,故图象为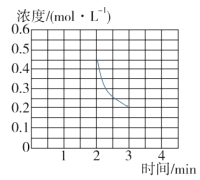 ;
;
(3) ①由图可知,升高温度NO2转化率减小平衡逆向移动,所以正反应放热,则△H<0;
②则从图中可以看出,同一个温度下,x对应的NO2的转化率均小于3:4对应的NO2的转化率,因投料比越大NO2的物质的量越大,NO2的转化率反而越小,故x>3:4;
③6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(l),所以400K时,反应的平衡常数表达式为K= c7(N2)/c6(NO2)c8(NH3);
7N2(g)+12H2O(l),所以400K时,反应的平衡常数表达式为K= c7(N2)/c6(NO2)c8(NH3);
④投料比为3∶4时P点达平衡,Q点未达平衡,此时NO2的转化率比平衡时小,说明此时要继续转化更多的NO2,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大,则可知此时逆反应速率比平衡时逆反应速率小,以氨气表示反应速率得出,Q点v逆(NH3)<P点v逆(NH3)。