题目内容
【题目】如表中物质分类完全正确的是 ( )
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 盐酸 | 水玻璃 | 硫酸 | 干冰 |
B | 小苏打 | 漂粉精 | 铁 | 氨气 |
C | 液氨 | 碱石灰 | 氢氧化钠 | 二氧化碳 |
D | 硝酸 | 食盐水 | 氯化铜 | 氯气 |
A. AB. BC. CD. D
【答案】C
【解析】
A. 盐酸是HCl的水溶液,属于混合物,A项错误;
B. 铁是单质,不是电解质,B项错误;
C. 液氨是液态的氨气,属于纯净物,碱石灰是氢氧化钠与氧化钙的混合物,氢氧化钠是电解质,二氧化碳属于非电解质,C项正确;
D. 氯气是单质,不属于非电解质,D项错误;
答案选C。

【题目】(1)下列各组分子中,属于含极性键的非极性分子的是 _______________
BF3 、 H2S 、 CH3Cl 、 NH3 、 CS2、 C60、 C2H4 、 HCl
(2)按所示格式填写下表中的空格:
原子序数 | 原子的价电子排布式 | 周期 | 族 |
17 | ①______ | 第三 | ②______ |
③______ | 3d54s1 | ④______ | ⅥB |
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是______,配离子 [Cu(NH3)4]2+中提供孤对电子的原子是_______________。
(4)镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的的价电子排布式为3d10,则其杂化轨道类型为____,Ni(CO)4是_____(填“极性”或“非极性”)分子。
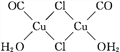
(5)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为____;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含有____个配位键,____个σ键。